醫療器械注冊電子申報信息化(eRPS)系統電子申報目錄解讀
- 2019-06-03 16:49
- 作者:李耀華
- 來源:中國健康傳媒集團-中國食品藥品網
為貫徹落實中共中央辦公廳、國務院辦公廳《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號)有關要求,國家藥品監督管理局于近日發布《關于實施醫療器械注冊電子申報的公告》(2019年第46號),醫療器械注冊電子申報信息化系統(eRPS)即將啟動運行。eRPS系統將我國現行醫療器械注冊申報資料要求以國際醫療器械監管機構論壇(IMDRF)注冊申報規范(RPS)項目的目錄列表(ToC)形式完整展示,有利于指導注冊申請人進行醫療器械注冊申報資料準備,最大程度依托信息化系統方便行政相對人進行注冊申報。
一、背景
中國現行的注冊申報資料要求源于《關于公布醫療器械注冊申報資料要求和批準證明文件格式的公告》(2014年第43號公告,以下簡稱43號公告)和《關于公布體外診斷試劑注冊申報資料要求和批準證明文件格式的公告》(2014年第44號公告,以下簡稱44號公告)和相關規范性文件,醫療器械注冊申請人需要按照43、44號公告的要求準備注冊申報資料并提出注冊申請。IMDRF的RPS項目工作組于2014年發布注冊申報資料目錄(Table of Content,ToC)并于2018年4月份進行了修訂更新。此目錄涵蓋了國際上通用和各成員國的地區性特殊要求,且預期會成為國際醫療器械注冊申報的統一目錄要求,各成員國亦在積極的轉化落地過程中。國家藥監局高度重視在各級法規規章制定過程中充分考慮采納或參考IMDRF各工作組的研究成果,eRPS系統的建設為我國將RPS-ToC目錄的轉化落地提供了契機。
二、研究
RPS-ToC包括醫療器械目錄表(nIVDMA ToC)和體外診斷試劑目錄表(IVDMA ToC),均分為6個章節,分別為第1章地區性監管信息、第2章申報產品綜述、第3章非臨床研究資料、第4章臨床研究資料、第5章說明書標簽和宣傳材料、第6A章質量管理體系程序、第6B章產品的質量管理體系相關信息。每一章目錄根據具體內容可劃分不同層級。RPS-ToC文件在各級標題后備注有通用要求和地區性要求,并在各級標題后明確了具體的資料說明。各國在使用RPS-ToC時,可結合本國國情制定相應的分類列表以體現地區性監管差異。
通過對比分析RPS-ToC目錄與我國43、44號公告對注冊申報資料的要求,可發現兩組文件雖然目錄設置形式和層級不同,但通用的技術性要求基本一致。圖1和圖2分別將43、44公告中的申報資料要求列表與RPS-ToC相應的章節目錄框架進行了交叉比對。
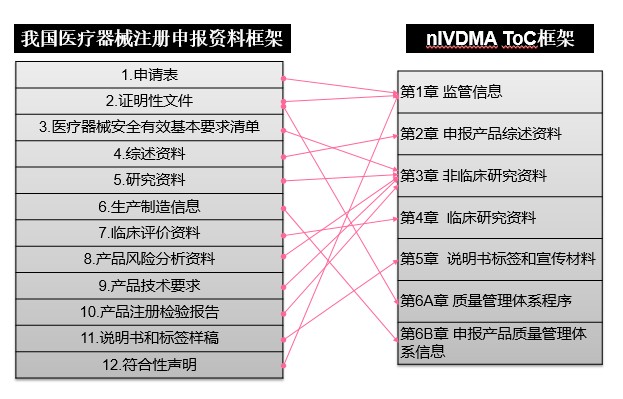
圖1 醫療器械注冊申報資料框架對應情況
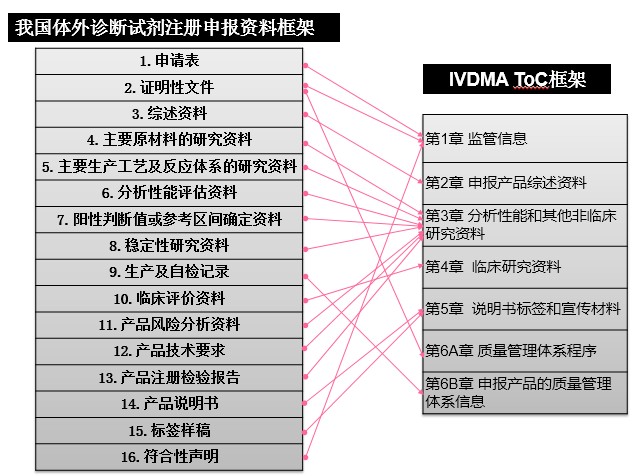
圖2 體外診斷試劑申報資料框架對應情況
RPS-ToC文件第一章為監管信息,對應43/44號公告的申請表、證明性文件和符合性聲明等內容。RPS-ToC文件第二章為申報產品綜述資料,對應43、44號公告的綜述資料。RPS-ToC文件第三章為非臨床研究資料,對應43號公告的安全有效基本要求清單(EP)、技術研究資料、產品風險分析資料、產品技術要求、產品注冊檢驗報告,對應44號公告的主要原材料的研究資料、主要生產工藝及反應體系的研究資料、分析性能評估資料、陽性判斷值或參考區間確定資料、穩定性研究資料、產品風險分析資料、產品技術要求、產品注冊檢驗報告。RPS-ToC文件第四章為臨床研究資料,對應43、44號公告的臨床評價資料。RPS ToC文件第五章為說明書標簽和宣傳材料,對應43、44號公告的說明書和標簽樣稿。RPS-ToC文件第六章為質量管理體系文件,對應43、44號公告中有關質量管理體系的證明性文件和生產制造信息。
三、應用
1. RPS-ToC文件將各章內各級標題逐級展開、細化,最多可到5級標題。nIVDMA ToC共有206個標題,IVDMA ToC共有210個標題。各層級標題后附有通用要求和地區性要求,并且在各章節后設置“其他資料”的申報空間。我國43號公告對于注冊申報資料框架分為一級標題和二級標題;44號公告對于注冊申報資料框架分為一級標題,并通過說明的形式以文字表述闡明各標題申報資料應包括的內容。RPS-ToC目錄的章節設置及各章內的拓撲層級設置更為合理、清晰
2. RPS ToC文件中體外診斷類設備歸屬在IVDMA ToC中,在“CH3.6.1電氣系統:安全性、機械和環境保護以及電磁兼容性”、“CH3.6.2獨立軟件/軟件組件”等標題中體現對于體外診斷類醫療器械電氣系統、軟件的要求。我國的體外診斷類設備的資料要求執行43號公告,按醫療器械進行管理。因此eRPS系統的IVD電子目錄關閉了有關體外診斷類設備的相關要求。
3. RPS ToC文件涵蓋了所有成員國對于注冊申報資料的要求,有些條款并不適用于我國情況或者我國法規并未對相應條款進行要求,差異內容主要體現在第一章和第六章。第一章中醫療器械唯一標識(UDI)、環境評價、臨床試驗證書、含有處方藥或非處方藥說明的適用范圍聲明等內容屬于他國的地區性要求;我國在境內第三類醫療器械的注冊質量管理體系核查、進口產品的質量管理體系證書等要求與第六章有關質量管理體系文件的要求也不盡相同。對于體外診斷試劑,我國法規并未要求提交EP清單、實質性等同結論等。eRPS系統電子提交目錄充分考慮了這些差異內容,關閉了不適用的目錄并對部分目錄的資料說明按43/44的要求進行了適當修訂。
4. RPS ToC文件的適用性提交屬性包括必須提交(R)、適用性提交(CR)和無需提交(NR)三類。eRPS系統設置為:R目錄必須上傳文件否則無法成功提交;CR目錄由申請人判斷是否需要提交;NR目錄設置為關閉狀態,雖有目錄展示但無需上傳文件。
5.部分中國法規要求的文件在RPS ToC文件的地區性要求中無法找到合適的對應標題。本次eRPS系統建設充分考慮考慮了所有43、44號公告的要求,對個別目錄的對應要求做了適當調整,保證中國法規要求的完整性。
6.關于第六章質量管理體系,目前RPS-ToC的要求明顯高于我國43、44號公告有關質量管理體系認證的要求,eRPS系統中保留了第六章的目錄,但根據我國法規要求關閉了其中多數子級目錄,待下一輪法規修訂完成后再結合實際情況開放相關資料提交的通道。
四、結論
eRPS系統電子提交目錄將43、44號公告的注冊申報資料要求以RPS-ToC的形式進行設置,目錄層級和有關格式要求按照IMDRF相關的國際通用規范進行設定,但在具體申報資料要求方面基本保留了目前我國醫療器械注冊申報資料要求,在充分考慮注冊申報資料要求的延續性、方便注冊申請人準備申報資料的同時,緊跟國際前沿,與國際通用的注冊申報規范要求接軌,旨在提升我國醫療器械的研發水平,推動產業健康發展,提升國際競爭力。(作者:醫療器械技術審評中心 李耀華)
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:)
右鍵點擊另存二維碼!
-
為你推薦
互聯網新聞信息服務許可證10120170033
網絡出版服務許可證(京)字082號
?京公網安備 11010802023089號 京ICP備17013160號-1
《中國醫藥報》社有限公司 中國食品藥品網版權所有