每周醫藥看點(12月1日—7日)
- 2025-12-08 15:42
- 作者:
- 來源:中國食品藥品網
國家醫保局、人力資源社會保障部印發《國家基本醫療保險、生育保險和工傷保險藥品目錄(2025年)》和《商業健康保險創新藥品目錄(2025年)》;國家藥監局發布《仿制藥參比制劑目錄(第九十九批)》,其中包括奧德昔巴特膠囊等品種。……12月1日—7日醫藥行業的這些動態值得關注。
行業·政策動態
1.國家醫保局、人力資源社會保障部印發《國家基本醫療保險、生育保險和工傷保險藥品目錄(2025年)》。目錄調整新增114種藥品,其中50種1類創新藥;調出了29種臨床沒有供應或可被其他藥物更好替代的藥品。一同發布的還有《商業健康保險創新藥品目錄(2025年)》,共納入19種藥品,包含CAR-T細胞治療產品和多款罕見病治療藥物。
2.國家藥監局發布《仿制藥參比制劑目錄(第九十九批)》,包括奧德昔巴特膠囊等品種。同時,國家藥監局還發布《調出參比制劑目錄品種清單(第三批)》,為藥用炭膠囊。
3.國家醫保局發布《關于開展藥品價格登記查詢服務的公告》。公告顯示,國家醫保局與北京市人民政府加強相關合作,認可北京相關國資企業開展藥品價格登記查詢服務;醫藥企業可自主申報登記創新藥價格,登記范圍逐步擴展至有價格登記意愿的其他藥品。
4.國家藥監局藥品審評中心(CDE)發布通知,將江蘇威凱爾醫藥科技股份有限公司的安瑞替尼膠囊納入兒童抗腫瘤藥物研發鼓勵試點計劃(星光計劃)。該試點項目擬開發的兒童適應證為攜帶神經營養酪氨酸受體激酶(NTRK)融合基因的實體瘤。
5.CDE發布《疫苗臨床試驗不良事件分級標準指導原則(修訂版)》,旨在通過對不良事件的嚴重程度進行合理分析和判定,規范不良事件分級,提高疫苗安全性評估的科學性。該指導原則自發布之日起施行。
6.12月3日,CDE分別就《化學仿制藥藥學研究重大缺陷(試行)(征求意見稿)》和《化學仿制藥生物等效性研究重大缺陷(試行)(征求意見稿)》面向社會公開征求意見,旨在促進化學仿制藥質量提升,指導企業研發,嚴格仿制藥技術審評,提高審評效率。征求意見時限均為自發布之日起1個月。
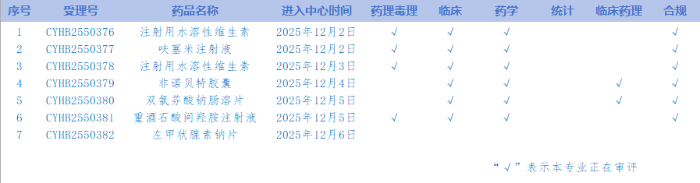
7.CDE網站公示7個仿制藥一致性評價任務(詳見表),涉及注射用水溶性維生素等品種。
產品研發·上市信息
1.國家藥監局發布3期藥品批準證明文件送達信息,共包括38個受理號,涉及昆明源瑞制藥有限公司等企業。
2.CDE承辦受理71個新藥上市申請,包括清金化痰顆粒等。
3.和其瑞醫藥宣布,公司的靶向催乳素受體的單克隆抗體HMI-115已獲得美國食品藥品管理局(FDA)授予快速通道資格認定。HMI-115擬用于治療子宮內膜異位癥相關的中重度疼痛。
4.石藥集團宣布,集團開發的GLP-1/GIP受體雙偏向性激動多肽注射液SYH2069注射液的臨床試驗申請已獲得FDA批準。SYH2069注射液擬用于肥胖或超重合并至少一種體重相關合并癥人群的體重管理。
5.正大天晴藥業集團宣布,集團的1類新藥TQF3250膠囊的臨床試驗申請已獲得FDA批準。TQF3250膠囊擬用于減重適應證。
醫藥企業觀察
1.科倫博泰宣布,與Crescent Biopharma,Inc.達成合作。此次合作涉及科倫博泰的抗體偶聯藥物SKB105,以及Crescent的雙特異性抗體CR-001。兩款候選藥物均用于治療實體瘤。根據合作條款,科倫博泰授予Crescent Biopharma,Inc.在美國、歐洲等國家及地區的研究、開發、生產和商業化SKB105的獨家權利;Crescent Biopharma,Inc.授予科倫博泰在中國研究、開發、生產和商業化CR-001的獨家權利。
2.先聲藥業宣布,與蘇州旺山旺水生物醫藥股份有限公司訂立許可協議。根據協議,先聲藥業將獲得氫溴酸氘瑞米德韋干混懸劑在中國用于抗呼吸道合胞病毒感染以及抗人偏肺病毒感染適應證的獨家許可權益。
3.華東醫藥宣布,全資子公司華東醫藥(杭州)有限公司與貴州生諾生物科技有限公司及該公司全資子公司上海生諾醫藥科技有限公司、江蘇太瑞生諾生物醫藥科技有限公司(以下簡稱生諾醫藥)達成獨家商業化合作協議。根據協議,生諾醫藥作為藥品上市許可持有人,負責利那拉生酯的研發、注冊、生產和供應;華東醫藥將負責利那拉生酯在中國的商業化推廣工作。
藥品集中采購
1.上海市醫藥集中招標采購事務管理所發布公告,公布2025年9月部分短缺藥的全國平均價。公布的藥品品種包括重酒石酸去甲腎上腺素注射液等。同時,公告要求,醫療機構根據市場供需情況,在保供穩價的基礎上,采購質量可靠、價格適宜的藥品。
2.根據上海市醫藥集中招標采購事務管理所發布的通知,因未按要求調整藥品價格,自2025年11月28日起暫停上海信誼金朱藥業有限公司生產的甲硫酸新斯的明注射液(規格:2ml:1mg*1支/支,中硼硅玻璃安瓿裝)的采購資格。
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:劉思慧)
右鍵點擊另存二維碼!
-
相關閱讀
-
為你推薦