每周醫藥看點(7月21日—27日)
- 2025-08-04 15:07
- 作者:劉鶴
- 來源:中國食品藥品網
中國食品藥品網訊 國家藥監局決定將人參北芪膠囊等藥品由處方藥轉換為非處方藥;國家藥監局藥品審評中心(CDE)發布《生物類似藥藥學相似性研究的問題與解答》……7月21日—27日,醫藥行業的這些動態值得關注。
行業政策及藥監動態
1.國家藥監局發布公告,將人參北芪膠囊、腦心舒口服液、鹽酸氨溴索滴劑由處方藥轉換為非處方藥。
2.國家藥監局決定對復方甘草酸單銨S注射劑(包括注射用復方甘草酸單銨S、復方甘草酸單銨S氯化鈉注射液、復方甘草酸單銨S注射液)說明書內容進行統一修訂,涉及“不良反應”“注意事項”“老年用藥”“相互作用”項。
3.國家醫保局辦公室發布《關于公布智能監管改革試點地區和試點單位的通知》。通知明確,經定點醫藥機構自愿報名、各省級醫保局推選、國家醫保局篩選,確定試點地區92個(其中天津、河北、山東、海南、貴州、青海、寧夏為全省域范圍內試點)、試點定點醫藥機構359家。通知要求,各省級醫保局用好國家醫保局分批次公開發布的智能監管“兩庫”規則及其知識點,做好智能監管改革試點工作。
4.CDE發布《生物類似藥藥學相似性研究的問題與解答》,旨在指導和規范生物類似藥的藥學相似性研究,為不同申報階段的藥學研究提供參考。
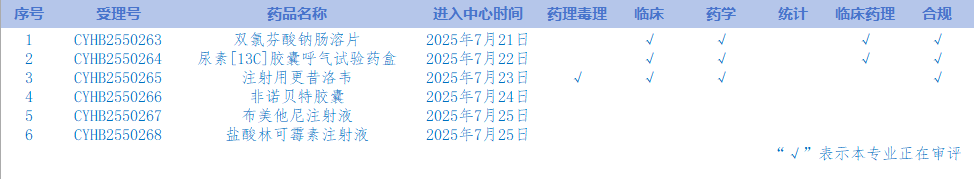
5.CDE網站公示6個仿制藥質量和療效一致性評價任務,涉及雙氯芬酸鈉腸溶片等品種。
產品研發上市信息
1.國家藥監局發布3期藥品批準證明文件送達信息,共包括144個受理號,涉及西安京西雙鶴藥業有限公司等企業。
2.CDE承辦受理56個新藥上市申請,包括注射用GD-11等。
3.勁方醫藥宣布,其口服KRAS G12D抑制劑GFH375/VS-7375獲得美國食品藥品管理局(FDA)授予快速通道資格認定,用于KRAS G12D突變局部晚期或轉移性胰腺導管腺癌的一線及后線治療。
4.映恩生物宣布,其新一代HER3抗體偶聯藥物DB-1310獲得美國FDA快速通道資格認定,用于治療接受第三代EGFR酪氨酸激酶抑制劑治療和含鉑化療治療期間或之后疾病進展、攜帶EGFR 19外顯子缺失或L858R突變的晚期/不可切除或轉移性非鱗狀非小細胞肺癌成人患者。
5.先聲藥業宣布,旗下先聲再明自主研發的靶向FGFR2b的抗體偶聯藥物SIM0686的新藥臨床試驗申請獲得美國FDA批準。
醫藥企業觀察
1.科弈藥業宣布,與美國生物醫藥公司ERIGEN LLC就科弈藥業自主研發的并聯增強型雙靶向CAR-T細胞治療產品KQ-2003達成獨家海外授權許可協議。根據協議條款,ERIGEN LLC將獲得KQ-2003在相關區域的獨家開發、注冊和商業化權利,以及使用KQ-2003關鍵專利結構與序列用于開發通用型CAR-T細胞療法的權利;科弈藥業將獲得1500萬美元近期開發里程碑付款,并有資格獲得最高達13.2億美元的研發、注冊及商業化階段里程碑付款。
2.亞盛醫藥宣布,與國藥控股、上藥控股、華潤天津醫藥分別簽署合作協議,旨在通過發揮各方在研發創新、市場開拓與渠道管理方面的優勢,推進亞盛醫藥自主研發的新型口服Bcl-2選擇性抑制劑利沙托克拉的商業化進程。
藥品集中采購
廣東省藥品交易中心就《廣東聯盟常見病慢性病藥品接續采購文件(征求意見稿)》公開征求意見。征求意見稿中的采購清單涉及阿米卡星、阿莫西林克拉維酸、氨芐西林等38個品種。(劉鶴整理)
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:周雨同)
右鍵點擊另存二維碼!
-
相關閱讀
-
為你推薦