2022年CDE發布的技術指導原則傳遞重要信號—— 關注患者臨床需求?鼓勵特殊人群用藥研發
- 2023-02-20 10:43
- 作者:施櫻子
- 來源:中國醫藥報
對比醫藥行業大環境的起起伏伏,2022年的藥品監管政策環境整體平穩。從指導原則視角看,藥監部門愈加重視臨床研究患者獲益,鼓勵特殊人群新藥研發,追蹤引導新型制藥技術發展。其中,關注臨床需求的研發理念被不斷強調。
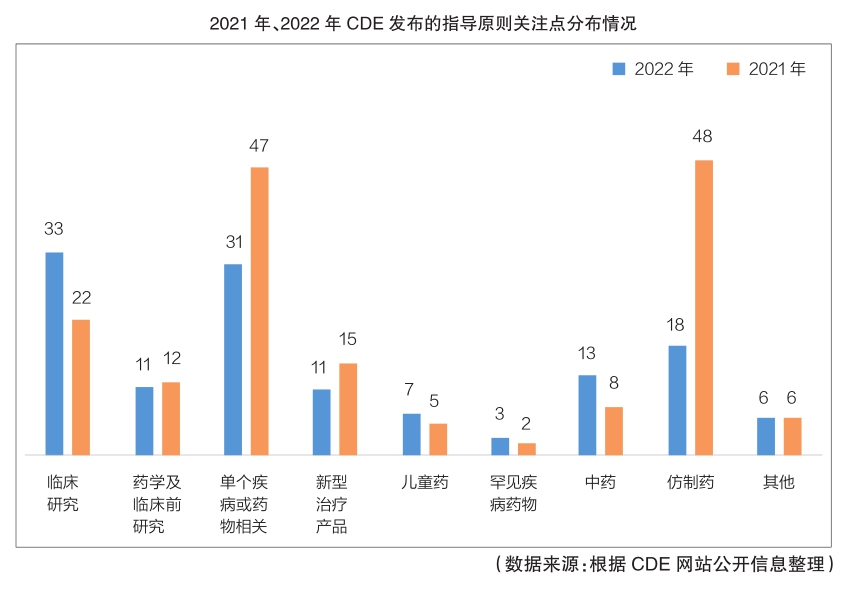
筆者統計顯示,2022年度,國家藥監局藥品審評中心(CDE)共對外發布指導原則60項,發布指導原則的征求意見稿73條(注:為方便表述,下文所稱“指導原則”既包括已正式發布的指導原則,也包括指導原則的征求意見稿)。與2021年相比,總體發布數量有所減少,主要原因是仿制藥及一致性評價相關指導原則發布數量大幅下降,但新藥研發有關指導原則發布數量及占比則繼續呈現上升趨勢。
筆者根據指導原則內容的關注重點,將其分為臨床研究、藥學及臨床前研究、單個疾病或藥物相關、新型治療產品、兒童藥、罕見疾病藥物、中藥、仿制藥等九個類別,試進行統計及分析,以探討藥品研發和申報上市過程中藥監部門的關注點,供業內人士參考。(注:不同類別指導原則的發布數量及變化情況如圖所示,數量為正式發布文件和征求意見稿的數量加和)
推動患者成為新藥研發主動參與者
新的指導原則表明了藥監部門越來越重視患者在新藥研發中的參與,從規章層面強調新藥研發要將患者從產品的被動使用者轉化為主動參與者,認同患者對新藥研發起到的正向推動作用。
2022年,與臨床研究有關的指導原則發布數量較上一年增加最為明顯,在其標題中,“患者”是高頻詞匯。如正式發布的《患者報告結局在藥物臨床研發中應用的指導原則(試行)》《組織患者參與藥物研發的一般考慮指導原則(試行)》,以及《以患者為中心的臨床試驗獲益-風險評估技術指導原則(征求意見稿)》《以患者為中心的臨床試驗設計技術指導原則(征求意見稿)》《以患者為中心的臨床試驗實施技術指導原則(征求意見稿)》等。
這些指導原則均提到將患者端(包括患者家屬、監護者、看護者以及患者組織等)的體驗、需求、觀點、偏好等納入新藥研發目標及臨床試驗數據收集的考慮范圍,同時也為申辦方獲得相應信息提供實操方法。
早在2021年發布的《以臨床價值為導向的抗腫瘤藥物臨床研發指導原則》,就開始提及新藥研發需以患者為核心,關注產品臨床價值,為患者提供更優治療選擇。只是在當時,該指導原則更多地被業界解讀為應對腫瘤領域的同靶點新藥研發扎堆而發布。
時至今日,筆者認為,該指導原則更像是推行“以患者為中心”藥物研發理念的序章。2022年更多“患者”相關指導原則的發布,則是對“以患者為中心”藥物研發理念在實操方面的進一步細化。
近年來,由于技術手段進步以及新冠疫情等因素影響,去中心化臨床試驗方法已在越來越多產品的臨床研究中被采用,這一做法本身即朝著以患者為中心的研究方向邁進。研究中使用的可穿戴設備等已開始更多地用于收集患者體驗信息。例如,在特應性皮炎治療產品的臨床研究中,研究者會讓受試者佩戴睡眠監測手環,以收集治療產品對患者夜間瘙癢抑制及對患者睡眠情況改善的影響。
指導原則還為研發企業與患者溝通,以及研究過程中收集患者數據明確了合規范圍。
一些國內企業在啟動研究中心前,為使受試者招募更加順利而提早了解患者分布等信息,但又擔心這樣做存在合規風險。《組織患者參與藥物研發的一般考慮指導原則(試行)》中明確了這一做法的合規性,即必要時申請人可組織收集未參加臨床試驗的患者意見,用于完善、優化臨床試驗方案,也包括分析關于招募困難或臨床試驗開展前未預料的問題等。
同時,指導原則也提示了藥監部門的下一步關注重點。例如,根據《患者報告結局在藥物臨床研發中應用的指導原則(試行)》《以患者為中心的臨床試驗獲益-風險評估技術指導原則(征求意見稿)》等,可以推測未來的新藥審評除了關注治療產品對疾病改善的客觀指標,也可能更加關注患者用藥后的體驗和生活質量改善等主觀指標,研發企業對此應提前布局。從整體上看,患者需求將是今后新藥研發更加繞不開的話題,藥監部門未來會對此愈加關注。
為特殊人群用藥研發提供便利途徑
除了“以患者為中心”的理念,2022年CDE發布的指導原則還提示了這樣的信號:藥監部門持續關注并解決兒童及罕見病患者這兩個特殊群體的用藥可及性問題。相對應的指導原則發布數量較2021年增加。
在兒童藥方面,2022年CDE共發布2項正式指導原則、5項征求意見稿,對兒童藥研發面臨的問題給予全方位關注。其中包括對臨床存在迫切需求的兒科疾病新藥研發提供技術指導,提出參考成人患者研究數據開發兒童藥的具體方法,同時針對兒童的心理生理特點,明確兒童藥研發的注意事項。相關指導原則的發布,旨在降低兒童藥研發者參與門檻。
值得一提的是,《兒童用藥溝通交流申請及管理工作程序(征求意見稿)》表明藥監部門在藥品審評審批方面亦將對兒童藥提供特別支持。該征求意見稿提到屬于四類溝通交流情形的兒童藥Ⅱ類會議,由企業提出調整會議類型申請,符合條件的Ⅱ類會議將調整為Ⅰ類會議,召開時限由60日縮短為30日。Ⅱ類會議多在新藥研發及上市的關鍵節點召開,縮短溝通時限將切實加快兒童藥創新研發進程。
罕見病藥物研發則在2022年迎來關鍵指導原則《罕見疾病藥物臨床研發技術指導原則》及《罕見疾病藥物臨床研究統計學指導原則(試行)》的發布,兩者于2022年初和年中正式發布。
罕見病由于發病率和患病率極低,疾病類型繁多、表型復雜,臨床表現多樣化,臨床醫生對疾病的認知普遍不足。開展罕見疾病新藥臨床開發,在臨床研究常見問題以外還面臨諸多困難。而上述指導原則提到,在確保嚴謹科學的基礎上,可以采用更為靈活的設計,充分利用有限的患者數據,獲得滿足獲益-風險評估的科學證據,用于支持監管決策。此項內容直擊罕見病藥物臨床開發的關鍵難題。
兒童及罕見病患者經常是新藥研發中易被忽視的群體,社會各界對加快兒童及罕見病用藥研發更是呼聲已久。在藥監部門的關注和政策鼓勵下,能否順利化解這些特殊群體的用藥難題?曾被企業視為風險大利潤低的兒童藥和罕見病藥研發,接下來是否會因為政策調整成為企業的“香餑餑”?雖然市場反應尚等待時間檢驗,但可以預見,2023年藥監部門還會在此領域繼續發力。
快速追蹤引導新型治療產品研發
2022年發布的指導原則還反映出藥監部門對新型治療產品研發的密切追蹤,以及對創新程度更高的新產品持有開放監管態度。
近年來,新型治療手段快速涌現,細胞治療、基因編輯、RNA干擾、腫瘤疫苗、溶瘤病毒、雙特異性抗體、抗體偶聯藥物(ADC)等療法接連出現,國內藥企也不再只是新藥研發的跟隨者。在熱點新型治療產品的研發中,不少中國公司已能與全球技術引領者齊頭并進。
面對研發的迅猛勢頭,從指導原則發布看,監管者選擇主動作為,意欲讓政策跑在企業前面。與新型治療產品相關的指導原則及征求意見稿,2022年發布數量達11項,連續兩年超過兩位數。
其中,《雙特異性抗體抗腫瘤藥物臨床研發技術指導原則》《抗腫瘤抗體偶聯藥物臨床研發技術指導原則(征求意見稿)》《腫瘤治療性疫苗臨床試驗技術指導原則(征求意見稿)》等,均是對應產品研發領域的首個臨床開發指導原則,而目前這些領域的多數產品研發尚處早期階段。
藥監部門在這類指導原則的撰寫中秉持了與行業共同探索的態度。例如,在《抗腫瘤抗體偶聯藥物臨床研發技術指導原則(征求意見稿)》中,大篇幅提及ADC產品在早期研發階段,要廣泛開展探索性研究,并對ADC已經產生的有限失敗或成功案例進行分析,提醒研發者早期階段研究的注意事項,但并未要求企業在研發中遵循具體的操作路線。
從指導原則中還能看到藥監部門對新型治療產品研發的支持。如《單臂臨床試驗用于支持抗腫瘤藥上市申請的適用性技術指導原則(征求意見稿)》,旨在給突破性藥物研發加快獲批提供指導和依據。該征求意見稿提出,試驗藥物前期探索性研究數據提示臨床療效突出的,可以依據單臂研究結果予以附條件批準。
已發布的指導原則表明,藥監部門正在引導新型治療產品研發從關注速度轉向關注質量,指導原則有助于新技術順利度過成長初期,而不是野蠻生長。廣泛開展探索性研究,能幫助研發者在早期階段了解更多產品風險和未知信息,也會在研究探索中更關注臨床需求,不再扎堆于個別靶點及品種研發。
(作者單位:研發客)
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:陸悅)
右鍵點擊另存二維碼!
-
為你推薦