政策+資本雙輪驅動 License out量價齊增
- 2021-08-30 18:14
- 作者:馮玉浩
- 來源:中國食品藥品網
根據不完全統計,2020年1月至2021年8月,國內創新藥對外授權合作(License out)項目達到39個,其中僅2020年,License out項目就已超過去五年之和;2021年License out依舊火熱,截至8月底,國內醫藥企業又有14個品種成功出海,超2019年國內醫藥企業全年License out之和。受益于政策和資本的共同推動,我國License out數量快速增長,License out價格再創新高。
License out呈現新趨勢
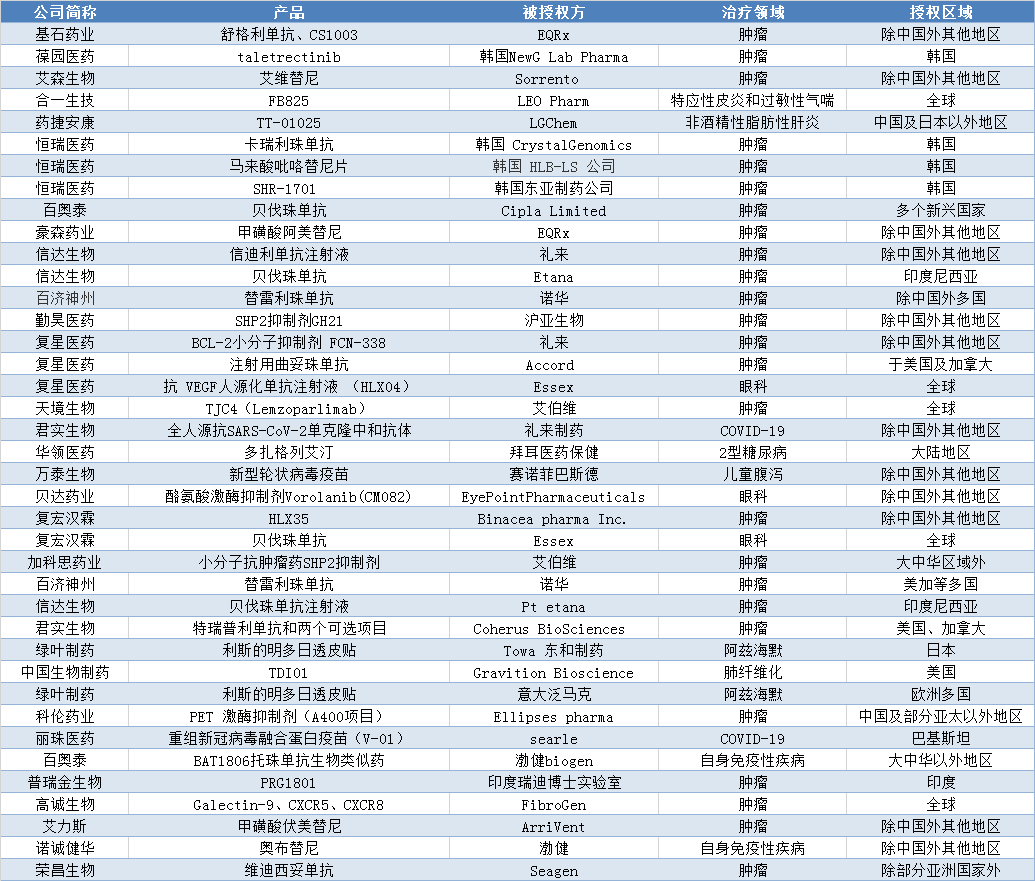
我國藥物License out呈現新趨勢。適應癥更加多樣,眼科類、疫苗類、神經退行性疾病類專利產品相繼進入國際市場;更多企業參與其中,未盈利的上市藥企也通過授權合作來回籠資金、補充研發;被授權方更加多元,形成了跨國藥企和區域性醫藥企業共同參與的新格局(見表1)。
2020-2021.8.30 License out項目不完全統計
來源:公開資料統計
適應癥更加多樣。在過去的License out項目中,抗腫瘤類藥物占據絕對多數;2020年后,其他適應癥逐漸增加。如針對2型糖尿病的國產創新藥多扎格列艾汀、萬泰生物的新型輪狀病毒疫苗,中國生物制藥的治療肺部纖維化創新藥TDI01等。
License out成為未盈利的生物技術公司回籠資金、補充研發的又一途徑。如百奧泰、信達生物、君實生物等公司都采用對外授權合作的方式來回籠資金。2020年,信達生物研發支出較上年增加43%,虧損較上年減少42.0%,這受益于公司和Etana、禮來制藥簽訂的授權合同,僅授權費及服務一項就為公司創造了14.76億元的收入。2020年君實生物與禮來制藥就全人源抗SARS-CoV-2單克隆中和抗體達成授權協議,僅技術許可一項為君實生物創收4.05億元,約占其主營業務收入的四分之一,為該公司上漲八成的研發費用提供了保障;2021年2月,君實生物就特瑞普利單抗和兩個可選項目在美國、加拿大的獨占權利和Coherus達成協議,為此將獲得最高可達11.1億美元的相關款項,此收入將為公司后續研發提供保障。
授權對象更加豐富。過去,國內創新企業License out的合作對象大多為跨國藥企,如阿斯利康、默克集團、禮來制藥、默沙東等。但2020年以來,越來越多的區域性藥企成為新的合作對象,如意大泛馬克、美國初創藥企EQRx等等。
同時,授權區域也逐漸細化。如麗珠醫藥就V-01與巴基斯坦的Searle公司達成合作,相關產品進入巴基斯坦;恒瑞醫藥的卡瑞利珠單抗、馬來酸吡咯替尼片、SHR-1701分別授權給韓國Crystal Genomics、HLB-LS以及東亞制藥;瑞普金生物的PRG1801授權給了瑞迪博士實驗室,進入印度市場。由此可見,越來越多的授權項目向更細分的市場滲透。
License out價格不斷走高。8月9日榮昌生物發布公告,將自主研發的抗HER2抗體偶聯藥物(ADC)維迪西妥單抗的除部分亞洲國家外的開發和商業化權利授予美國生物制藥企業Seagen,此次交易包含了2億美元的首付款,24億美元的里程碑款,以及銷售凈額提成。一舉刷新了不到一年前,由天境生物抗腫瘤藥物CD47單抗lemzoparlimab創下的19.4億美元的授權款項記錄。
政策+資本雙輪驅動,醫藥創新厚積薄發
審評審批制度改革不斷深化,藥物創新迎來發展新機遇。2015年國務院發布《關于改革藥品醫療器械審評審批制度的意見》,2017年中辦國辦發布《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》,這兩份文件對醫藥創新發展,起到了統領全局的作用,文件多次強調要對新藥和創新醫療器械給予優先審評審批。與藥品相關的職能部門也紛紛出臺政策措施,促進醫藥行業創新發展。
2020年7月開始實施的新修訂《藥品注冊管理辦法》中特別增設藥品加快上市注冊程序一章,設立突破性治療藥物、附條件批準、優先審評審批、特別審批四個通道,支持以臨床價值為導向的藥物創新。2020年7月8日,隨著《突破性治療藥物審評工作程序(試行)》《藥品附條件批準上市申請審評審批工作程序(試行)》《藥品上市許可優先審評審批工作程序(試行)》三個重磅文件的發布,和《國家食品藥品監督管理局藥品特別審批程序》一道,開啟了新藥上市的四條“高速公路”,藥品審批大幅提速,藥企創新意愿大大加強。
國家藥監部門加入ICH(國際人用藥品注冊技術協調會),我國藥品注冊領域與國際接軌,藥品監管部門、制藥行業和研發機構逐步采取和實施國際藥品領域的高標準,引入全球通行的藥物研發與注冊技術要求。這一方面提升了國內制藥行業創新力、競爭力,另一方面也有利于中國制藥融入國際醫藥產業鏈,中國藥品進入國際市場。
此外,財政部、科技部、國家醫療保障局等多部門也紛紛出臺政策,推動創新藥產業高質量發展。比如醫保制度改革實現“騰籠換鳥”,促進創新藥可及性提高。醫保目錄實現一年一次的動態調整,使創新藥能夠及時納入醫保。在不久前公布的《2021年國家醫保藥品目錄調整通過初步形式審查的申報藥品名單》中,部分今年剛剛獲批上市的創新藥已經被納入初審名單,其中包含阿伐替尼片、CAR-T產品阿基侖賽注射液等。創新藥進入醫保速度大幅提升,可幫助創新藥企加速回籠資金,是對醫藥創新的有力推動。
資本市場助力優質創新企業成長
新藥研發存在著“資金投入大、研發周期長、市場風險高”等多重挑戰。行業常以“十年十億美元”描述新藥研發所面臨的漫長時間和龐大投入。審評審批制度改革大大縮短了國內創新藥的研發周期,資本市場也降低上市門檻,為醫藥創新提供資金保障。
上海證券交易所發布的科創板股票上市規則中,為了支持和鼓勵具備研發實力的醫藥企業在科創板上市,對醫藥企業放寬了財務指標方面的限制,不再設置營業收入要求;香港聯合交易所發布的《新主板上市規則》允許尚未盈利或未有收入的生物科技公司申請香港主板上市。上交所和聯交所為缺乏資金且有創新能力的生物科技公司降低了上市門檻,創新藥公司迅速得到了資本的青睞與支持。
以生物制藥領域為例,剛剛刷新了License out交易金額的榮昌生物,僅2020年就通過發行股票融資37.72億元。2020年該公司的研發支出進一步增加到4.66億元,較上年增加了32.29%,融資所得為公司的研發增長提供了物質保障。信達生物更是在2020年通過了三輪新股配售方案,成功籌集13億美元資金。公司年報顯示,多輪配售后的信達生物擁有現金18億美元,資金儲備為公司藥物研發、潛在業務合作、生產設施擴展等提供了強大支持。
根據藥審中心發布的數據顯示,僅今年上半年,我國1類創新藥的批準數量達到破紀錄的21個,超過2020年全年通過的創新藥數量。隨著鼓勵創新政策的不斷推出,藥審改革紅利的持續釋放和資金對生物醫藥領域的持續支持,我國創新藥在未來將會繼續涌現,而創新藥物也將乘東風出海,方興未艾。(馮玉浩)
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:陸悅)
右鍵點擊另存二維碼!
-
為你推薦
-

2021年9月第二周創新藥周報
2021年9月第二周,陸港兩藥地創新板塊共計18支個股上漲,23支個股下跌。其中漲幅前三為康寧杰瑞制藥-B(+9.74%)、百奧泰-U(+9.28%)、華領醫藥-B(+6.67%)。跌幅前三為開拓藥業-B(-9.74%... 2021-09-13 09:47 -
澳華即將上市,內鏡市場前景如何?
2021年8月18日上海澳華內鏡股份有限公司(簡稱“澳華內鏡”)科創板IPO已提交注冊,擬募資6.4億元。我們看到我國內窺鏡行業眾多公司陸續嶄露頭角,在我國消化系統疾病頻發的現狀下,內鏡市場前... 2021-09-13 09:45
互聯網新聞信息服務許可證10120170033
網絡出版服務許可證(京)字082號
?京公網安備 11010802023089號 京ICP備17013160號-1
《中國醫藥報》社有限公司 中國食品藥品網版權所有