廣州生物院等利用人肝類器官發現線粒體疾病的鐵死亡新病理
- 2021-03-11 16:14
- 作者:
- 來源:中國科學院官網
中國科學院廣州生物醫藥與健康研究院研究員劉興國課題組與山東大學科研人員合作,構建了線粒體DNA缺失綜合癥(MDS,Mitochondrial DNA depletion syndrome)病人特異性的及其CRISPR/Cas9修復的誘導多能干細胞,進而分化高純度3D肝類器官和2D肝樣細胞作為肝臟疾病的聯合模型。研究發現,MDS病人肝細胞對鐵沉積導致的鐵死亡(一種細胞的死亡方式)更為敏感,闡明線粒體溶酶體互作引發鐵死亡的病理,并篩選出N-乙酰半胱氨酸(NAC)作為潛在的候選藥物。該研究揭示了線粒體疾病的全新死亡模式、細胞器互作機制和潛在治療策略,相關研究成果以A combined model of human iPSC-derived liver organoids and hepatocytes reveals ferroptosis in DGUOK mutant mtDNA depletion syndrome為題,發表在Advanced Science上。
線粒體是真核生物細胞中最重要的細胞器之一,除了為細胞提供能量外,還參與調控細胞代謝、氧化應激、細胞死亡等多種生理活動,在細胞生、老、病、死等各方面發揮重要作用。線粒體DNA缺失綜合癥是由于維持線粒體DNA合成的核基因突變,線粒體DNA含量嚴重減少,導致多組織器官功能障礙的疾病,受累器官通常有肝臟、腦、肌肉等。病理表型具有組織特異性,目前已發現至少9種基因突變會導致MDS。劉興國課題組在前期工作中報道了丙戊酸誘發Alpers-Huttenlocher綜合征(由POLG突變導致的MDS)肝毒性的機理,并建立了相應的候選藥物篩選策略,是首次利用誘導多能干細胞(iPSC)技術建立遺傳特異的肝細胞毒理學模型,成為解決臨床問題的成功范例(Xingguo Liu*, Hepatology, 2015)。此后,劉興國課題組在線粒體疾病方向進行了持續深入的研究。
DGUOK是脫氧鳥苷激酶,是線粒體內合成嘌呤核苷酸重要的酶,該基因突變是導致肝腦型MDS最常見的遺傳背景因素。肝臟鐵沉積是其重要臨床表型,血清學檢查也顯示血清鐵蛋白和轉鐵蛋白升高。肝臟作為人體內主要的鐵貯器官,鐵過載時肝臟首當其沖成為鐵毒性攻擊的主要部位。然而尚無研究揭示鐵在這個疾病中起何種作用,DGUOK突變的MDS病人進展如此迅速且嚴重的肝衰竭病理機制尚未清楚,亟需深入研究,探尋有效治療手段。
基于此,科研人員將病人皮膚成纖維細胞重編程為iPSC,進行CRISPR/Cas9基因修復,保證了遺傳背景的一致性。隨后,科研人員利用高純度3D肝類器官分化培養技術排除膽管細胞干擾,并結合2D肝樣細胞分化技術,建立了一個更為強大可靠的體外肝臟疾病模型。研究發現,病人肝細胞線粒體DNA缺失導致線粒體功能障礙、ATP合成減少、和活性氧(ROS)大增。病人3D肝類器官和2D肝樣細胞均對鐵沉積導致的鐵死亡更敏感。這一鐵死亡是線粒體與溶酶體的細胞器互作事件:線粒體活性氧激增及谷胱甘肽耗竭,繼而核受體共激活因子4(NCOA4)介導鐵蛋白在溶酶體中降解,鐵蛋白里的鐵釋放到胞質中,引起脂質過氧化增加,最終導致肝細胞鐵死亡。進一步的工作篩選出谷胱甘肽的前體—N-乙酰半胱氨酸(NAC)可以顯著抑制病人肝細胞鐵死亡。
該研究首次將高純度3D肝類器官技術應用于遺傳性肝病研究,論證了MDS疾病發生鐵死亡的新病理,揭示出其臨床肝臟鐵過載的機制,并篩選出有效抑制鐵死亡候選藥物。此外,線粒體DNA缺失廣泛存在于衰老、退行性疾病和其他遺傳性疾病中,因此該研究具有廣泛的潛在病理和治療意義。研究工作得到國家重點研發計劃、中科院、國家自然科學基金、廣東省和廣州市的支持。
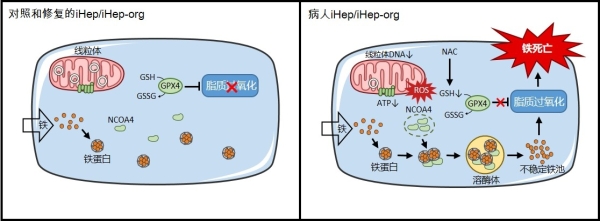
線粒體疾病肝細胞的全新鐵死亡模式、細胞器互作機制
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:劉思慧)
右鍵點擊另存二維碼!
-
為你推薦