每周醫藥看點(2.22~2.28)
- 2021-03-01 09:05
- 作者:李碩
- 來源:?中國食品藥品網
中國食品藥品網訊 《已上市中藥變更事項及申報資料要求》發布,婦產科用米索前列醇片說明書修訂……2月22日~2月28日,醫藥行業的這些事情值得關注。
行業政策動態
1.國家藥監局發布《已上市中藥變更事項及申報資料要求》,細化已上市中藥變更事項,明確申報資料要求,并對變更適用人群范圍、變更用法用量、替代或減去國家藥品標準或藥品注冊標準處方中毒性藥味或處于瀕危狀態的藥味、變更藥品說明書中安全性等內容這4項變更事項進行說明,明確相關技術要求,自2月24日起實施。
2.國家藥監局發布第三十八批仿制藥參比制劑目錄,涉及復方倍他米松注射液等藥品。
3.國家藥監局決定對婦產科用米索前列醇片說明書進行修訂,本品的上市許可持有人應按照說明書修訂要求,提出修訂說明書的補充申請,于5月24日前報國家藥監局藥審中心(CDE)或省級藥品監管部門備案。
4.CDE發布《放射性體內診斷藥物非臨床研究技術指導原則》,自2月25日起施行;發布《藥審中心技術審評報告公開工作規范(試行)》,自6月1日起施行;并就《基因修飾細胞治療產品非臨床研究與評價技術指導原則(試行)》征求意見稿,ICH Q5D、M9及M9問答實施建議公開征求意見。
5.國家藥典委發布有關中藥配方顆粒藥品標準制定的通知。通知指出,在6家生產企業試點成果的基礎上,已完成公示160個中藥配方顆粒國家藥品標準草案,近期將按程序報國家藥監局審批頒布。39個中藥配方顆粒國家藥品標準正在審評過程中,另有246個中藥配方顆粒品種已有企業正在開展標準研究。
產品研發/上市信息
1.國家藥監局附條件批準國藥集團中國生物武漢生物制品研究所有限責任公司的新型冠狀病毒滅活疫苗(Vero細胞)注冊申請。該疫苗適用于預防由新型冠狀病毒感染引起的疾病(COVID-19)。
2.國家藥監局附條件批準康希諾生物股份公司重組新型冠狀病毒疫苗(5型腺病毒載體)注冊申請。該疫苗是首家獲批的國產腺病毒載體新冠病毒疫苗,適用于預防由新型冠狀病毒感染引起的疾病(COVID-19)。
3.國家藥監局發布公告稱,2021年1月,國家藥監局共批準注冊醫療器械產品117個。其中,境內第三類醫療器械產品86個,進口第三類醫療器械產品14個,進口第二類醫療器械產品16個,港澳臺醫療器械產品1個。
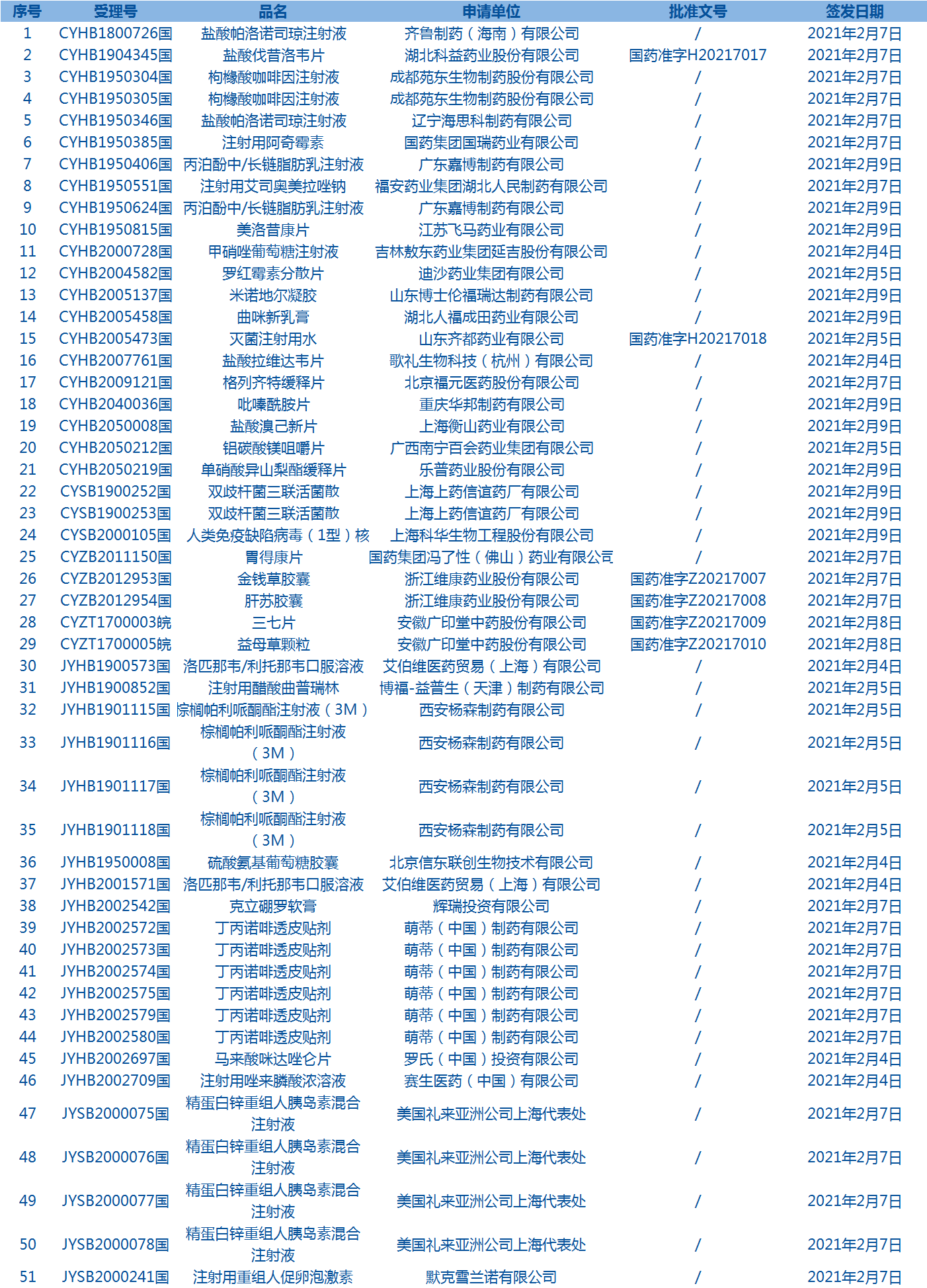
4.國家藥監局發布1期藥品批準證明文件待領信息,共包括51個受理號,涉及湖北科益藥業股份有限公司等企業。(截至2月28日)
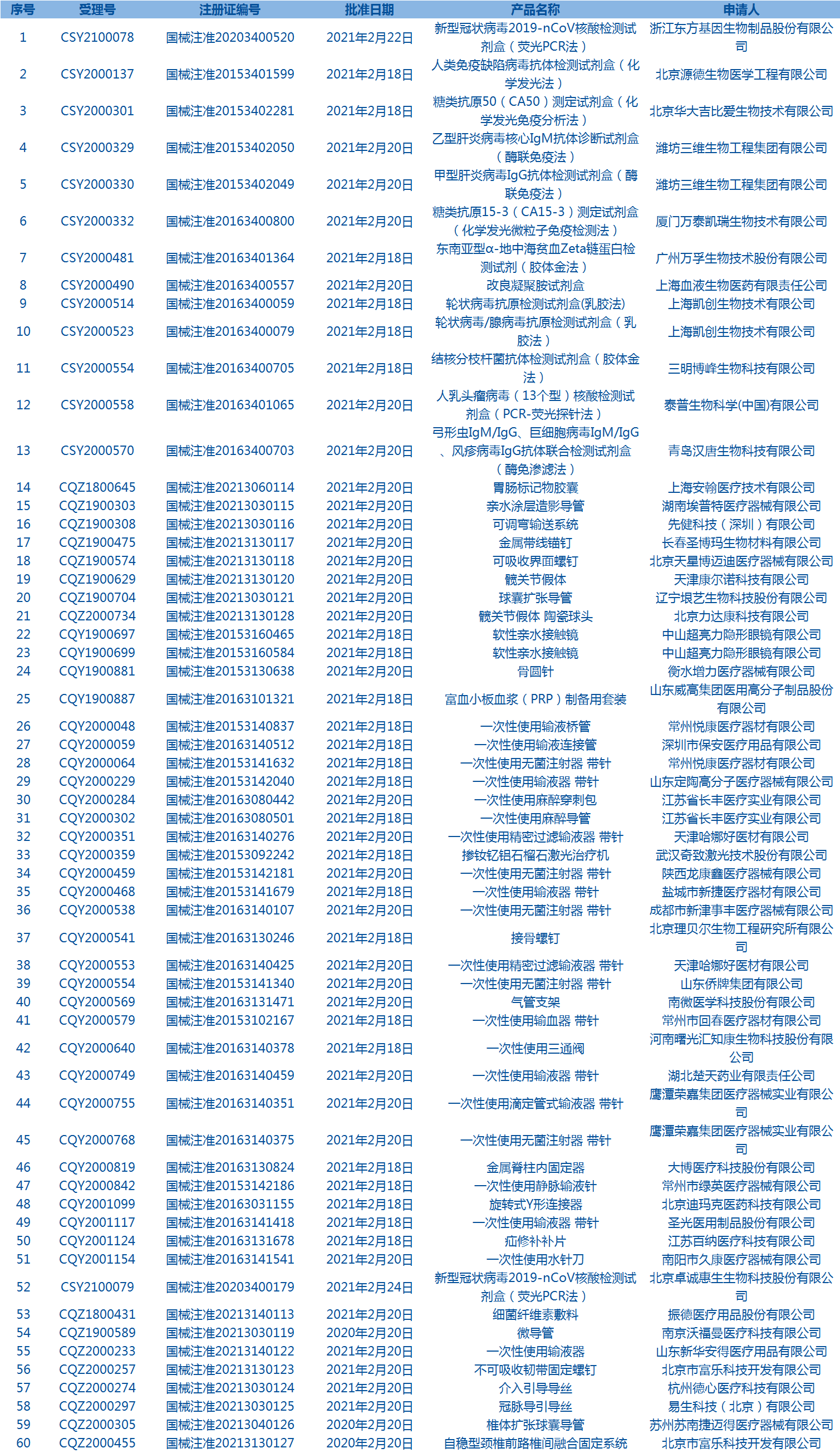
5.國家藥監局發布5期醫療器械批準證明文件(準產)待領信息,共包括60個受理號,涉及北京市富樂科技開發有限公司等企業。(截至2月28日)
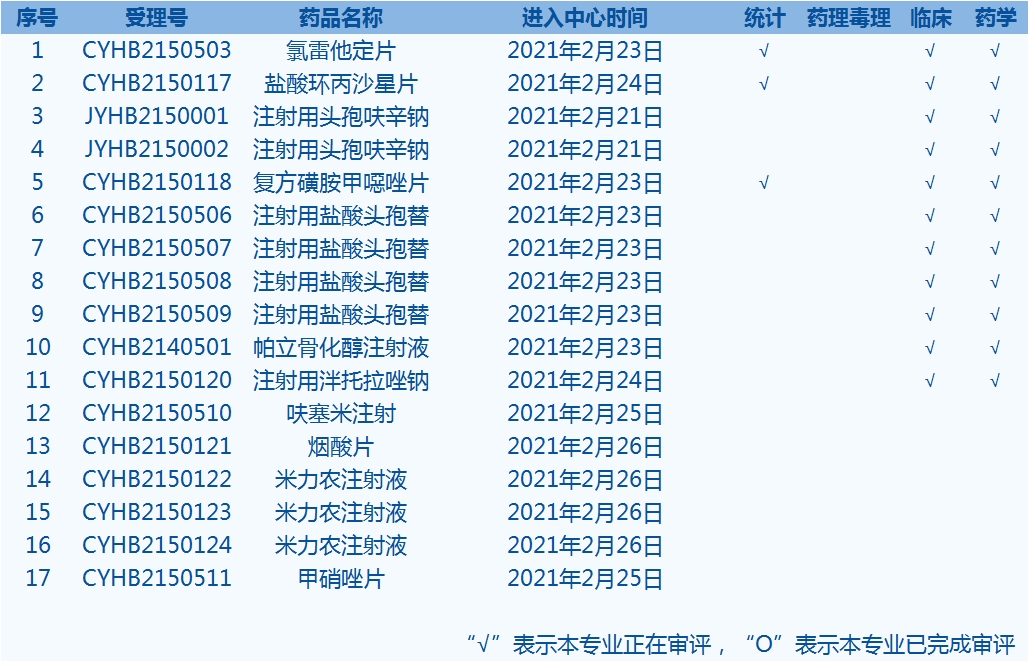
6.CDE網站公示17個仿制藥一致性評價任務,涉及氯雷他定片等藥品。(截至2月28日)
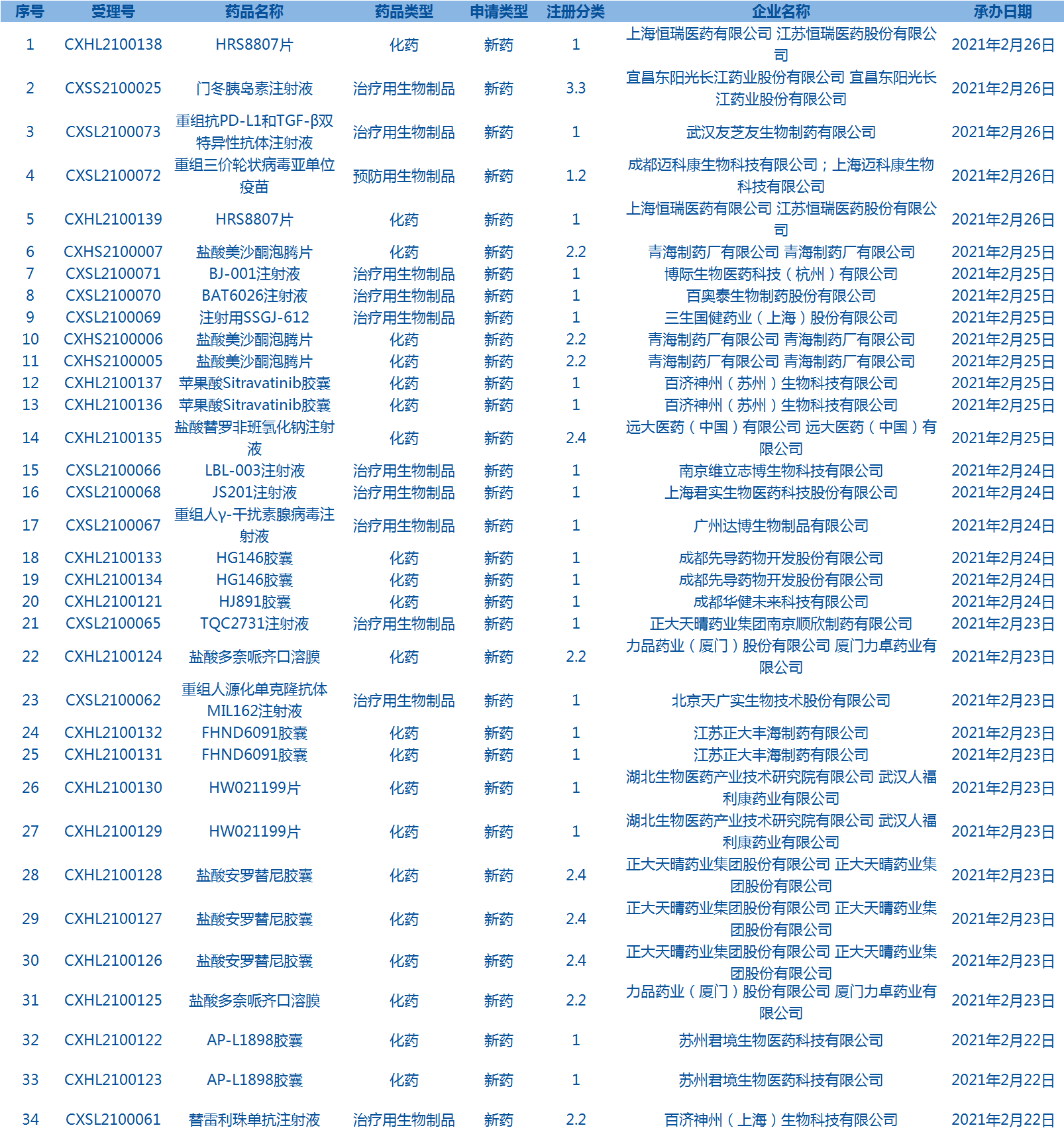
7.CDE承辦受理34個新藥上市申請,包括門冬胰島素注射液等藥品。(截至2月28日)
醫藥企業觀察
1.重慶太極實業(集團)股份有限公司發布公告稱,控股股東太極集團混改獲通過,國藥集團正式入主太極集團,成為太極集團實控人。
2.江蘇魚躍醫療設備股份有限公司首次通過股份回購專用證券賬戶以集中競價交易方式回購公司股份964000股,占公司總股本的0.1%,最高成交價為27.86元/股,最低成交價為27.6元/股,成交金額為26809205元。
3.依生生物制藥有限公司宣布完成逾1.3億美元B輪融資,本輪融資基金將用于公司研發中心建設,推動多個疫苗產品在中國和國際多中心臨床試驗,以及在中國和新加坡生物疫苗生產基地的建設,加速推進產品商業化的進程。
4.三葉草生物制藥有限公司宣布完成2.3億美元C輪融資并獲得超額募集。本輪融資后,三葉草生物在過去12個月的總融資額超過4億美元。
5.中國生物制藥宣布,該公司附屬公司北京泰德制藥股份有限公司與美國Graviton Bioscience Corporation簽訂了海外授權合作協議,在大中華區以外地區共同開發及商業化泰德制藥自主研發的治療纖維化創新藥TDI01。
6.藥明奧測宣布完成1.5億美元B輪融資。本輪融資將用于擴張開放式創新賦能平臺,加速整合診斷產品研發與全球產業布局。
藥械集中采購
1.甘肅省公共資源交易局發布《關于對申請撤廢藥品取消中標掛網資格有關事宜的通知》,對近期41家企業53個因生產線改造、成本上漲、原料短缺、停產等原因提交撤廢申請的藥品取消中標掛網資格。對此次撤廢品種,鼓勵其他企業同功能主治藥品申請陽光掛網,甘肅省對性價比優于平臺已中標掛網的藥品實行免備案陽光掛網。
2.云南省政府采購和出讓中心發布通知明確,3月1日起,各有關單位可對2020年國家醫保目錄中協議期內談判藥品進行采購交易。對于協議期內醫保談判藥品,有同通用名藥品上市的,企業可申請直接掛網,掛網價格不得高于同規格談判藥品醫保支付標準。
3.江西省醫保局發布通知,啟動第四批國家集采相關藥品掛網采購工作。非中選藥品生產企業應申報該產品的現行全國最低省級集中采購價格,并參照第四批國家集采中選價格,按照未過評藥不高于過評藥價格、過評藥不高于原研藥價格的原則,自主申報采購價格。(中國食品藥品網綜合整理/李碩)
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:李碩)
右鍵點擊另存二維碼!
-
為你推薦













