每周醫藥看點(3.15~3.21)
- 2021-03-22 08:36
- 作者:李碩 馮玉浩(實習)
- 來源:中國食品藥品網
中國食品藥品網訊 新修訂《醫療器械監督管理條例》發布,氟哌啶醇制劑及阿魏酸鈉注射制劑說明書范本修訂……3月15日~3月21日,醫藥行業的這些事情值得關注。
行業政策動態
1.新修訂《醫療器械監督管理條例》發布,自6月1日起施行。
2.國家藥品監督管理局發布《口腔膠原膜通用技術要求》,該醫療器械行業標準將于2022年4月1日正式實施;批準《重組膠原蛋白》和《組織工程醫療器械產品 膠原蛋白 第3部分:膠原蛋白含量檢測-液相色譜儀-質譜法》2項醫療器械行業標準制修訂項目立項。
3.國家藥監局發布《重組膠原蛋白生物材料命名指導原則》,以進一步規范重組膠原蛋白生物材料命名,推動新型生物材料高質量發展。
4.國家藥監局決定對氟哌啶醇制劑、阿魏酸鈉注射制劑說明書范本進行修訂,本品的上市許可持有人應依據有關規定,提出修訂說明書的補充申請,分別于6月14日、15日前報國家藥監局藥審中心(CDE)或省級藥品監督管理部門備案。
5.國家藥監局發布公告,將硝酸咪康唑陰道片處方藥轉換為非處方藥,品種名單及其非處方藥說明書范本一并發布。
6.國家藥監局發布國家醫療器械監督抽檢結果,在對電位治療設備、金屬接骨螺釘等14個品種進行的產品質量監督抽檢中,共33批(臺)產品不符合標準規定。
7.CDE發布《皮膚外用化學仿制藥研究技術指導原則(試行)》,自發布之日(3月16日)起施行。
8.國家藥監局器審中心就《網式霧化器注冊技術指導原則》等22個二類指導原則公開征求意見,征求意見截止時間為4月17日。
產品研發/上市信息
1.國家藥監局器審中心公示醫療器械優先審批申請審核結果,圣湘生物科技股份有限公司申請的“乙型肝炎病毒核糖核酸(HBV RNA)定量檢測試劑盒(PCR-熒光探針法)”屬于列入國家科技重大專項的醫療器械,符合優先審批情形,擬定予以優先審批。
2.國家藥監局通過優先審評審批程序批準成都華昊中天藥業有限公司申報的1類創新藥優替德隆注射液(商品名:優替帝)上市。優替德隆為埃坡霉素類衍生物,可促進微管蛋白聚合并穩定微管結構,誘導細胞凋亡。該藥為我國自主研發并擁有自主知識產權的創新藥。
3.國家藥監局批準北京北方騰達科技發展有限公司生產的創新產品“一次性使用電子輸尿管腎盂內窺鏡導管”注冊申請。該產品由頭端部、彎曲部、插入部、操作部、工作通道和連接部組成,在醫療機構中使用,與圖像處理裝置配合,用于人體尿道、膀胱、輸尿管腎盂的觀察成像。
4.國家藥監局發布的公告顯示,今年2月,國家藥監局共批準注冊醫療器械產品92個。其中,境內第三類醫療器械產品65個,進口第三類醫療器械產品11個,進口第二類醫療器械產品15個,港澳臺醫療器械產品1個。
5.國家藥監局發布6期醫療器械批準證明文件(準產)待領信息,共包括58個受理號,涉及杭州依圖醫療技術有限公司等企業。(截至3月21日)

6.國家藥監局發布2期藥品批準證明文件待領信息,共包括57個受理號,涉及百濟神州(北京)生物科技有限公司等企業。(截至3月21日)
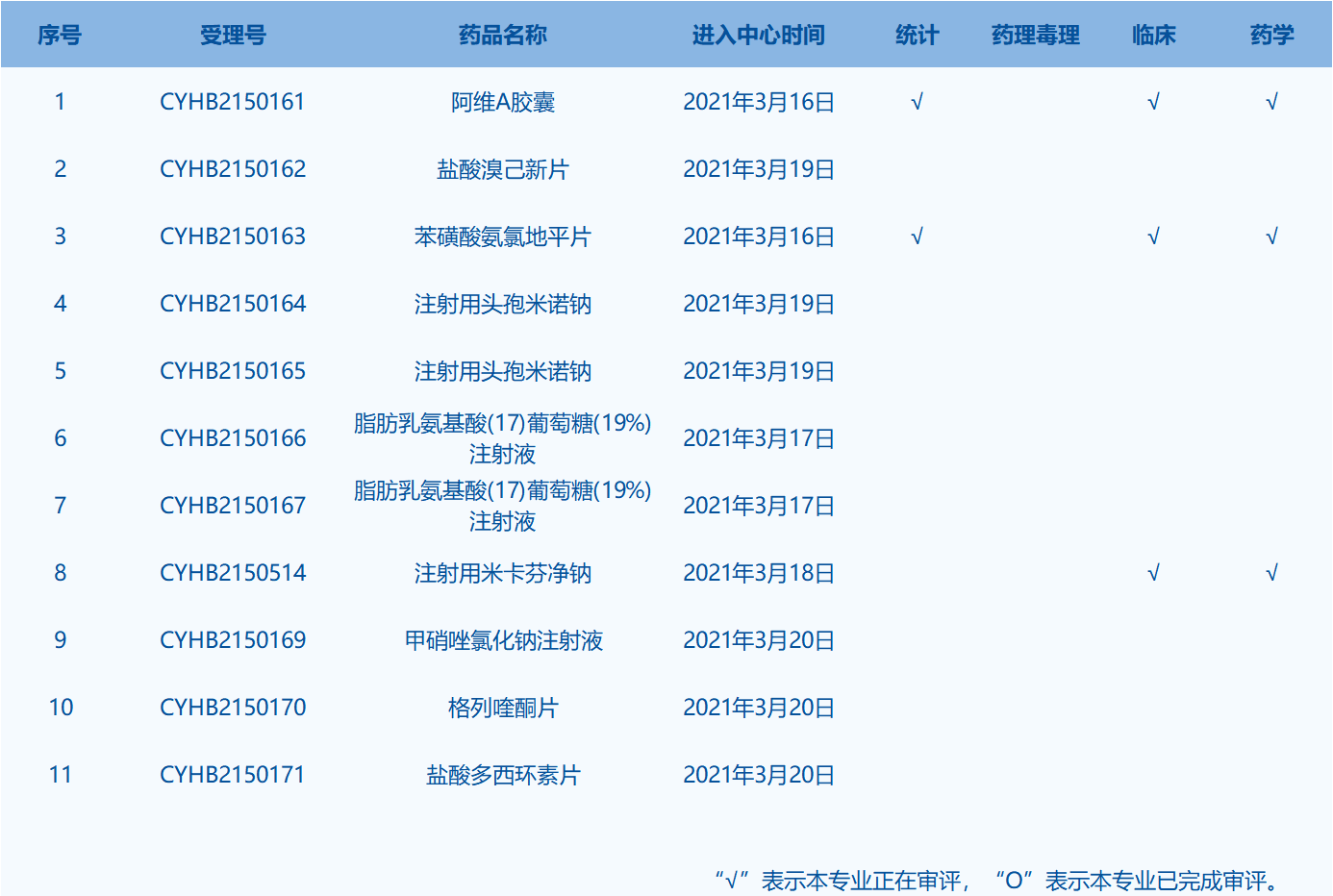
7.CDE網站公示11個仿制藥一致性評價任務,涉及注射用頭孢米諾鈉等藥品。(截至3月21日)
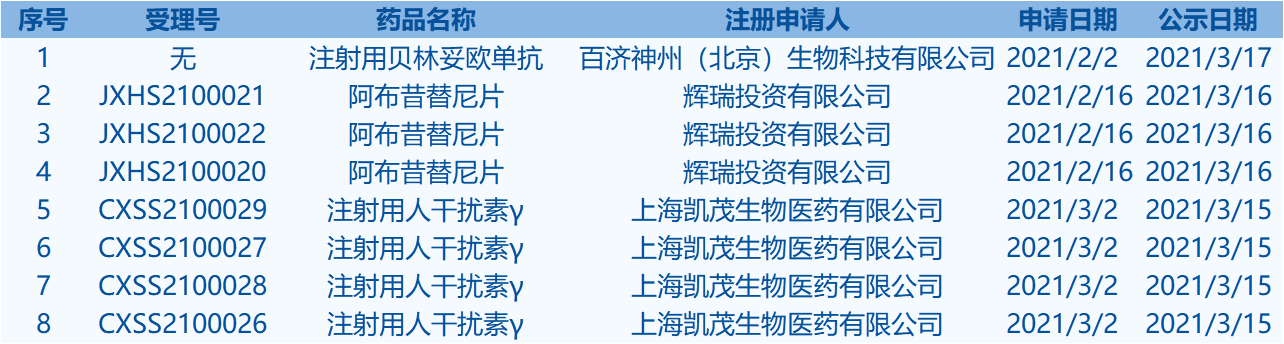
8.CDE網站信息顯示,阿布昔替尼片等8個藥品擬進入優先審評審批程序。(截至3月21日)
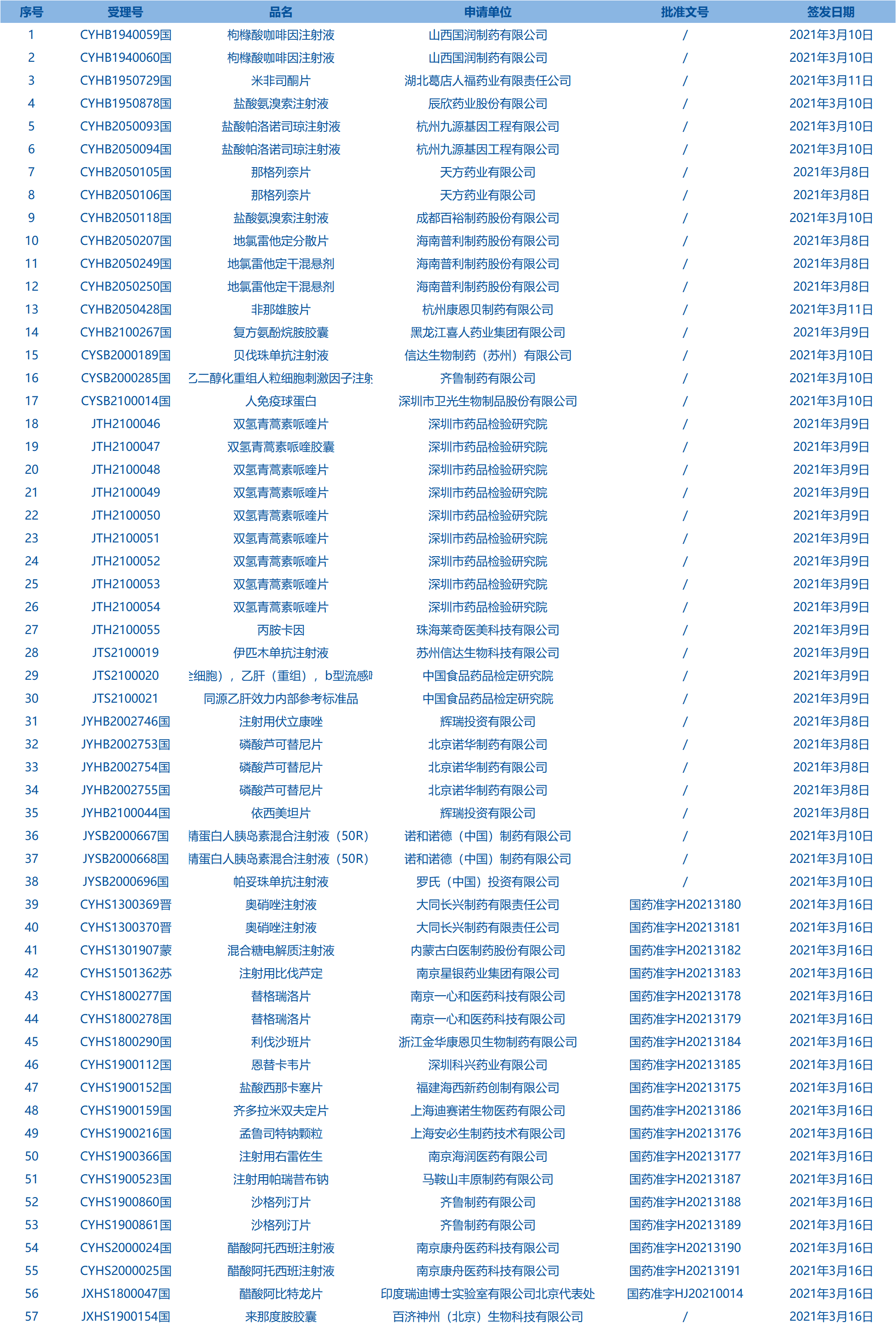
9.CDE承辦受理15個新藥上市申請,包括阿基侖賽注射液等藥品。(截至3月21日)

醫藥企業觀察
1.藥明生物宣布與康橋資本、聚明創投等達成一項收購協議,收購蘇橋生物超過90%的股份,預計將在2021年第二季度完成交易。此外,藥明生物與康橋資本建立了戰略合作,未來將賦能康橋資本被投企業發現、開發和生產生物藥。
2.上海證券交易所披露受理首藥控股科創板IPO申報材料。首藥控股計劃本次公開發行股票數量不超過3178萬股,初步計劃在科創板募集資金20億元,中信建投證券為保薦機構和主承銷商。
3.白云山醫藥集團控股子公司廣州醫藥股份有限公司向中國證監會遞交的首次公開發行境外上市外資股(H股)并在香港聯合交易所主板上市的申請材料已獲受理。
4.南方雙林生物制藥股份有限公司與中國信達資產管理股份有限公司深圳市分公司簽訂戰略合作協議,優化雙方在血液制品行業的資源整合、企業經營以及資本市場運作等資源,聚焦血液制品行業,整合產業資源。
5.青島海爾生物醫療股份有限公司計劃與青島高新技術產業開發區管理委員會合作,在青島市高新區建設海爾生物安全科創產業園,預計總投資金額不超過5億元。
6.綠葉制藥集團有限公司全資附屬公司綠葉瑞士與Italfarmaco訂立協定,授予后者新藥利斯的明多日透皮貼劑在歐洲四個國家的獨家商業化權利。
藥械集中采購
1.上海陽光醫藥采購網發布《關于對醫藥企業上傳價格和營銷行為信用承諾書情況的通報》。截至3月10日,有2068家醫藥企業和3896家配送企業未按要求上傳醫藥企業價格和營銷行為信用承諾書。對于逾期未提交的企業,自4月1日起陽光采購平臺將不再接受其新的投標或掛網申請;自6月1日起,其已中標或掛網的產品,如有其他企業保障供應或有替代品滿足臨床需要的,將做撤網處理。
2.江蘇省醫保局發布通知,要求做好第四批國家組織藥品集中采購結果落地實施工作,4月27日起開始執行中選結果。采購周期內若提前完成當年約定采購量,超出部分中選企業仍按中選價進行供應,直至采購周期屆滿。
3.重慶市醫保局發布關于推進藥品醫保支付標準與掛網價格協同的通知。通知指出,納入醫保支付范圍的藥品,將按照《重慶市藥品交易采購掛網工作細則(試行)》,通過競價、議價、聯動全國最低價等方式,形成合理的藥品價格,實現醫保支付標準與藥品掛網價格協同,完善醫保支付標準制度體系。重慶藥品交易所平臺的藥品掛網價格即醫保支付最高限額。【中國食品藥品網綜合整理/李碩 馮玉浩(實習)】
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:李碩)
右鍵點擊另存二維碼!
-
相關閱讀
- 從桂林山水走出來的醫療器械產業園——廣西壯族自治區藥監局“強監管”“暖服務”助力資源縣發展醫藥工業紀實(下)
- 從桂林山水走出來的醫療器械產業園——廣西壯族自治區藥監局“強監管”“暖服務”助力資源縣發展醫藥工業紀實(下)
-
為你推薦













