中國腫瘤免疫領域成長迅猛,更多潛力靶點待深耕
- 2020-06-23 14:09
- 作者:麥倩衡
- 來源:科睿唯安
日前,在科睿唯安舉辦的“深度聚焦——中國的下一代腫瘤免疫研究”在線大講堂上,科睿唯安生命科學與制藥事業部大中華區首席科學家王剛博士,分析了國內研發格局及尚待發掘的靶點;江蘇恒瑞醫藥股份有限公司副總經理兼首席醫學官鄒建軍博士和復星凱特生物科技有限公司總裁王立群博士,分享了他們對于進一步把握聯合用藥及細胞治療等新研發方向的見解。
全球腫瘤免疫領跑制藥行業
王剛博士說:“從全球腫瘤免疫領域的發展現狀來看,不管是研發管線、市場容量、專利申請,技術類型都持續增長,增長速度超越了全行業的平均發展速度。”
全球正在開發的活躍腫瘤免疫藥物從2017年的2030款增加到3876款。這些藥物分為6個大類,分別為T細胞靶向免疫調節劑、其他免疫調節劑、細胞療法、腫瘤疫苗、溶瘤病毒和靶向CD3的雙特異性抗體。細胞療法在過去兩年增長最快。
第一代腫瘤免疫藥物2015年全球市場銷售額為26億美金。隨著更多免疫檢查點抑制劑的上市和適應證的拓展,其2019年市場銷售猛增至240億美金,并預計在2025年突破560億美金。
在這樣的利好環境下,腫瘤免疫的專利申請量在2000年至2018年間平穩攀升,同時有11%的專利布局多達15個國家以上,由此可見,專利申請方對于這一領域長期看好。從技術類型來看,特異性單克隆抗體靶向療法和過繼性細胞療法增長最快。
對比中美兩國在腫瘤免疫領域的表現,從專利成長趨勢來看,近五年美國以69%的成長率領先全球,中國則以17%位居第二名,與美國仍有顯著差距。其中,美國在癌癥疫苗和細胞因子療法領域的專利比例穩步上升,中國的專利增長則呈現在特異性單抗和細胞療法領域。
中國研發管線競爭激烈,更多潛力靶點待深耕
國內腫瘤免疫研發最熱門靶點首三名是CD19、PD-1和PD-L1,遙遙領先CD47、CD3、BCMA、CTLA-4、IL-2、CD22和CD20等其他靶點,研發格局尚欠多元化。
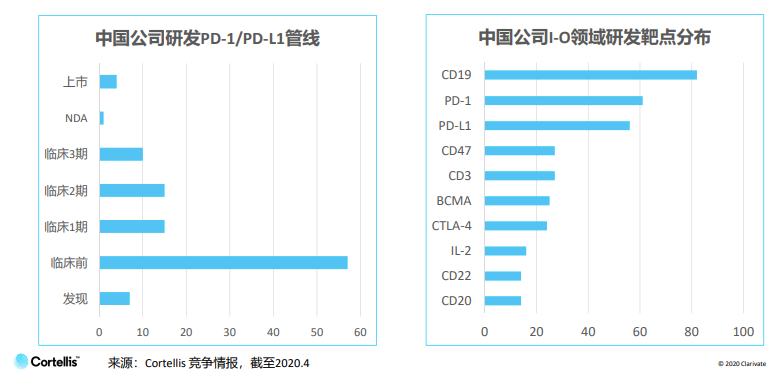
PD-1/PD-L1是國內最為人熟悉的靶點,除了8款已獲批上市的藥物外,還有近60個臨床前項目。面對擁擠的賽道,中國企業積極尋找出路,比如研發基于PD-1的聯合療法、尋找被忽略的細分領域、及提高藥物療效、安全性和患者依從性等。
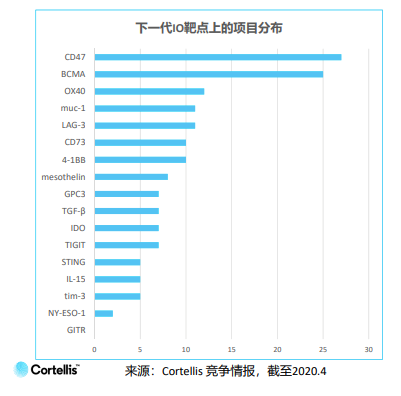
但放眼整個領域,仍有其他具有潛力的靶點值得深耕。分析全球超過3000個項目,科睿唯安尋找出18個尚無藥物上市的熱門靶點。
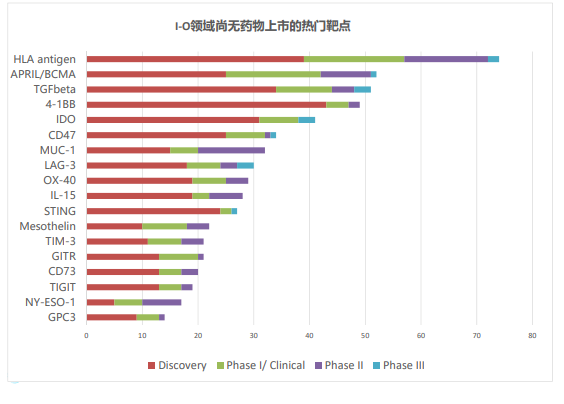
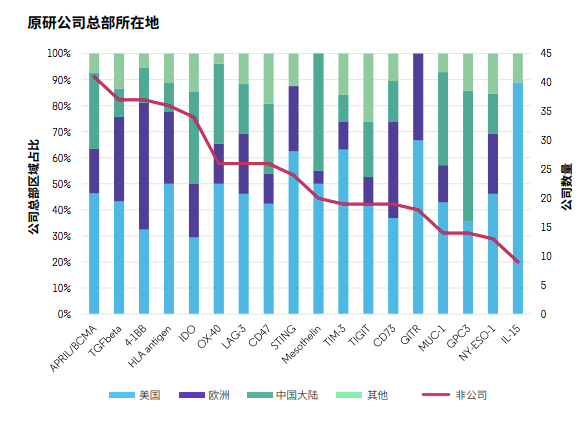
這些靶點分為三大類:T細胞靶點(抑制型:TIM-3,LAG-3,TIGIT;共刺激型:4-1BB,OX40,GITR)、其他免疫細胞靶點或腫瘤免疫微環境(CD73,IDO,IL-15,STING,TGF-β)和腫瘤細胞特異性或分化抗原(BCMA,CD47,GPC3,mesothelin,MUC-1,NY-ESO-1)。
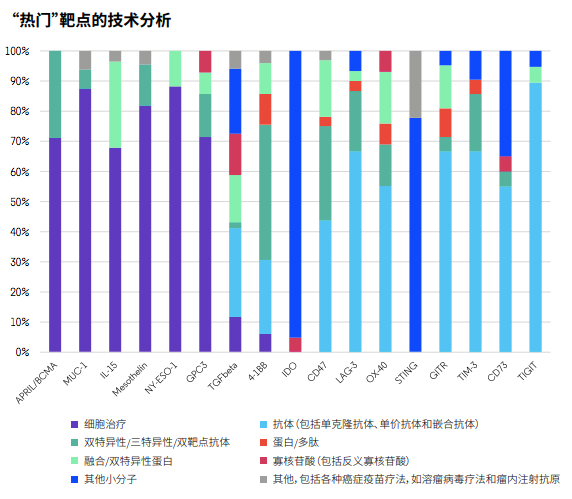
開發這些靶點雖能打開新市場,公司亦需制定出最可靠的路徑。分析發現,針對T細胞靶點和CD47及CD73最多的療法是抗體藥物,而針對BCMA、MUC-1、IL‐15、mesothelin、NY-ESO-1和GPC3開發的療法以細胞治療為最常見。另外,以IDO和STING為靶點的開發主要以小分子抑制劑為主,同時也有靶向TGF-β的多種不同類型項目。
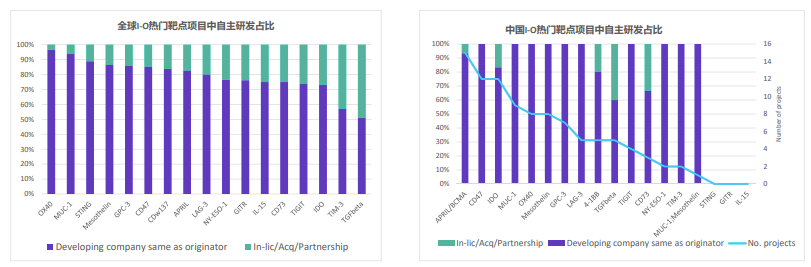
分析也發現,中國不論在靶點或技術類型方面都需要更加多元。
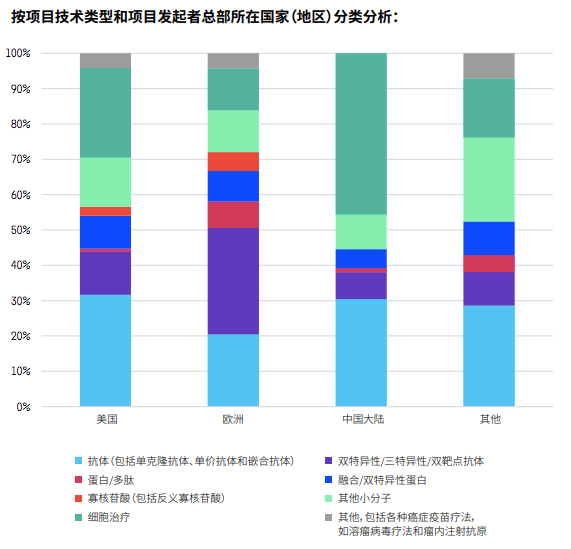
以領跑全球的美國為例,絕大多數靶點都有美國公司參與研發,占比超過30%。中國公司的參與度在某些靶點占比超過25%,比如BCMA、IDO、OX40、CD47、mesothelin、MUC‐1和GPC3,但很少有公司研究STING和GITR。而在分析項目技術類型時,也發現中國以細胞治療為主,相對欠缺多元化。
研究水平緊追國際,積極布局下一代靶點
盡管如此,中國的腫瘤免疫領域繼續活躍發展,并呈現幾個特點。
中國公司強調自主研發,78%的熱門靶點項目都是由發起該項目的同一家公司開發,僅7%來自合作。聯合用藥成為大趨勢,所有靶點均聯用PD1/L1抑制劑,另有一半聯用CTLA-4。
從2013年到2019年,國內腫瘤免疫領域交易量增長7倍,而同期整個制藥領域的交易量僅增長了4%。相比其他領域,美國公司在腫瘤免疫領域更愿意選擇引進中國項目,而中國公司則傾向選擇國內交易。
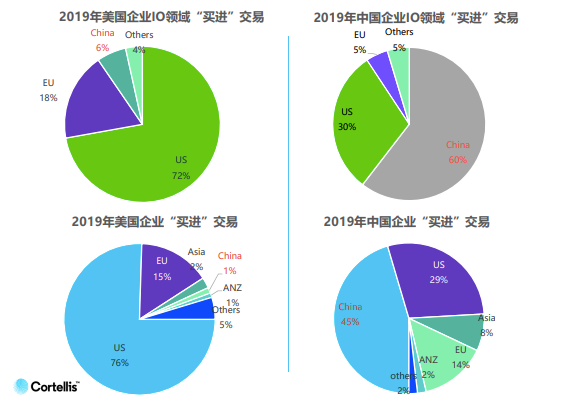
王剛博士說:“ 這說明了中國企業在腫瘤免疫領域選擇國內交易的比例遠高于全領域,同時也從側面說明了中國整體在腫瘤免疫領域的研究水平與國際水平距離更加接近,差距比其他領域要小,因此交易發生的比例相對高于其他領域。”
強調創新的中國公司亦開展下一代的腫瘤免疫研究。從項目開發數量及階段、海外臨床試驗進展、全球特殊資格認證方面,均見中國公司的積極布局。
中國下一代的腫瘤免疫靶點項目占全部項目的27%,大多數仍在臨床前階段。熱門的下一代靶點主要為CD47和BCMA,遠高于其他靶點。
其中,15%的臨床項目選擇開展海外臨床,集中在美國和澳大利亞,以臨床1期和針對晚期實體瘤為主。百濟神州和恒瑞各有兩項海外臨床項目,其他有布局的公司包括科濟生物、天境生物和信達生物等。
值得一提的是,科濟生物針對BCMA的候選CAR-T療法CT-053獲得FDA孤兒藥和再生醫學先進療法(RMAT),以及EMA優先藥物認定(PRIME)三項特殊資格。同樣靶向BCMA,由南京傳奇與楊森合作開發的LCAR‐B38M更獲得四項特殊資格認定。
免疫2.0時代:聯合用藥、新輔助治療、細胞治療
王剛博士認為,開展藥物聯用和開發下一代的腫瘤免疫療法,會是研究和投資的主要方向。他指出:“圍繞PD-1/PD-L1為基礎療法的應用方案取得了非常多的突破,今年國家藥監局授予羅氏的T+A(Tecentriq加Avastin)免疫聯合療法優先審評的資格,是一個藥物聯用的成功案例。”另外,隨著對于相關機理的加深理解,他認為沒有靶點會被判“死刑”。
鄒建軍博士表示,全球包括中國在內已進入“免疫2.0時代”,免疫治療作為基礎,聯合化療、放療等標準治療和抗血管生成藥物等,比起單藥使用在某些瘤種上療效更顯著。
因此,恒瑞除了推進其PD-1作為單藥外,也在積極開發聯合方案。在藥物聯用的策略上,鄒建軍博士提到結合臨床療效的循證醫學的重要性。循證醫學的證據顯示免疫聯合化療和抗血管治療有成效,使恒瑞決定作出這些嘗試。
“目前各種聯合方案都已經有非常豐富的理論基礎,但其實腫瘤細胞的異質性非常強,腫瘤抑制的微環境常對單一療法或不同聯合療法產生不一樣的反應,抗腫瘤策略必須聚焦多個途徑,才能充分激活內源性腫瘤免疫細胞,并使腫瘤免疫反應能夠不斷循環,方能打破治療瓶頸。”鄒建軍說,公司其中一個方向是聯合不同的免疫檢查點抑制劑,致力于解決已接受過免疫治療的病人出現復發和耐藥的情況。
他表示,在單用或聯合免疫治療布局上,主要考慮從作用機制上的協同增效,此外是安全性,不希望能夠帶來協同增效的同時,大幅度提高安全性隱患。
鄒建軍認為,新輔助治療會是未來免疫治療的一個重要方向。早期的癌癥病人免疫系統功能會較好,或能對免疫治療產生更好反應。但如何在不耽誤手術時機的前提下能達到最佳療效,還有用藥次數和時機等,仍有待驗證。
細胞治療也是下一代熱門領域,但存在各種監管、技術和定價的挑戰。王剛博士以Yescarta為例,指出對于個性化的創新治療,各國的衛生技術評估時間和意見不同,仍有待觀察監管機構會如何評估臨床療效和制造工藝。高昂的生產成本也帶來高定價隱憂,藥企需靈活平衡價格和患者可及性。
復星凱特專注于CAR-T治療,王立群博士早就關注到CMC是特別關鍵的問題,他認為,工藝的設計必須顧及質量和實操性,有一個嚴謹并經過驗證的工藝,才能保證最后成品的質量和屬性滿足安全性有效性。即使是同一個靶點,不一樣的工藝也可使最終產品的質量和臨床表現大相徑庭。
“隨著更多產品進入臨床和商業化運營,在我們積累足夠多的轉化數據后,希望有更多重要參數進入T細胞產品體外評估,通過不同的維度,真正讓我們做到有一定的預測性。”王立群說。
他同時指出了產業化和商業化面臨的挑戰,比如低溫冷鏈的物流要求,提高平行生產能力,和無前例可循的注冊檢驗程序等。他希望未來有更多資源投入腫瘤免疫領域,中國公司走出不同的途徑、找到不同的靶點,更加多樣化發展。
本文僅代表作者觀點,不代表本站立場。
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:李碩)
右鍵點擊另存二維碼!
-
為你推薦