2024年3月份美國Clinicaltrial數據庫臨床試驗數據顯示:單抗藥物臨床試驗數量飆升?中國貢獻六項研究
- 2024-05-09 14:32
- 作者:陳宇哲
- 來源:中國醫藥報
根據美國Clinicaltrial數據庫數據,2024年3月份,全球新增由企業資本主導的臨床試驗總數為733項,新開臨床試驗數量顯著上升,較2月份增長27.04%。單月新增臨床試驗數量低于2023年同期水平,同比下降5.66%。值得注意的是,當月圍繞單抗藥物新開展的臨床試驗數量大幅上升,其中有6項由中國企業開展。
新開臨床試驗整體情況
3月份,新開臨床試驗數量最多的企業(機構)是阿斯利康,申報數量為20項;隨后為默沙東和百時美施貴寶,分別為14項和13項。在全球新開臨床試驗數量排名前十的企業中,增幅最大的是諾華,新開臨床試驗數量從上月的2項增至當月的9項,月增幅為350%;其次是禮來和武田,增幅均為233.33%。排名前十的企業中,新開臨床試驗數量下滑幅度最大的企業為艾伯維,降幅為37.5%。
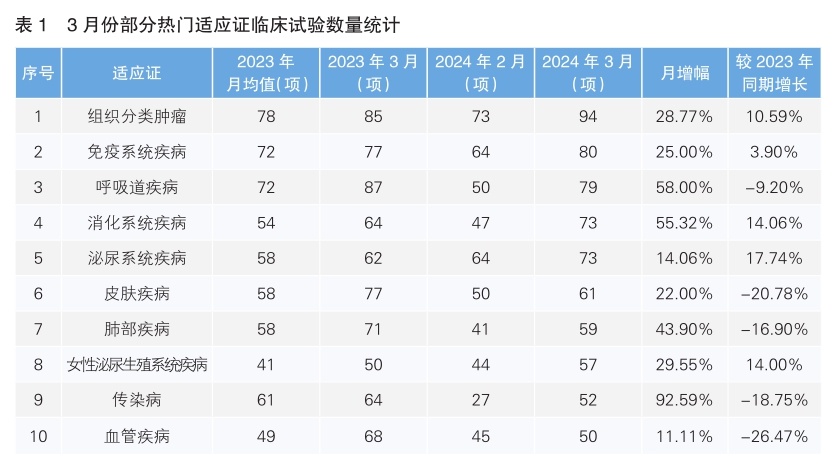
從3月份新增臨床試驗熱門適應證領域來看,組織分類腫瘤仍為最主要的熱門研發領域,試驗數量為94項,相較2月份增長28.77%;其次為免疫系統疾病,環比增長25%。月增幅最高的熱門適應證為傳染病,單月增幅為92.59%。月增幅最低的熱門適應證為血管疾病,單月增幅為11.11%。相較于2023年同期,同比增幅最為顯著的為泌尿系統疾病,增長17.74%;同比降幅最為顯著的是血管疾病,降幅為26.47%。(詳見表1)
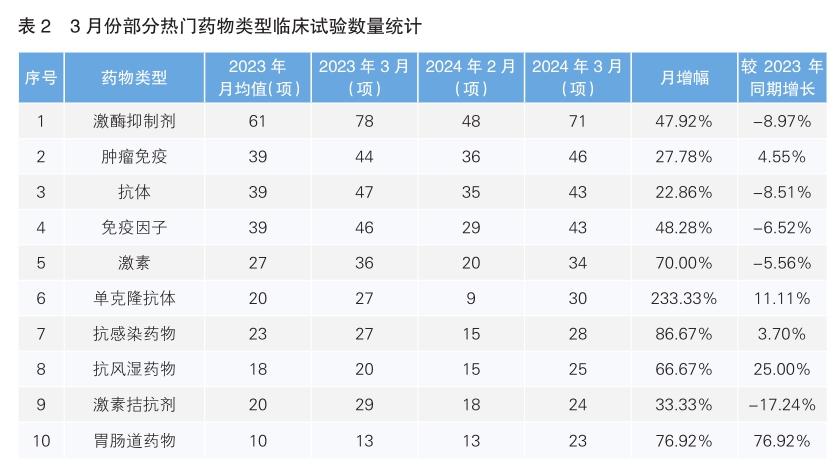
對新增臨床試驗藥物類型進行統計后發現,3月份最為熱門的藥物類型仍為激酶抑制劑,環比增長47.92%,但同比下降了8.97%;其次為腫瘤免疫藥物,環比增長27.78%,同比增長4.55%。月增幅最高的藥物類型為單克隆抗體藥物,增幅為233.33%,同比增長了11.11%。相較于2023年同期月降幅最大的藥物類型是激素拮抗劑,同比下降了17.24%。(詳見表2)
對新開臨床試驗的申請國家和地區進行統計后發現,當月美國仍為臨床試驗開展最多的國家,但數量環比下降了3.42%。其次是中國,新開臨床試驗數量與2月份持平。相較于2月份,熱門國家和地區多數新開臨床試驗數量下降,數量增長的國家有澳大利亞、法國和英國,其中英國的月增幅最高,為45%;德國的月降幅最大,為30.95%;同比增幅最高的為澳大利亞。
單抗藥物臨床試驗賽道火熱
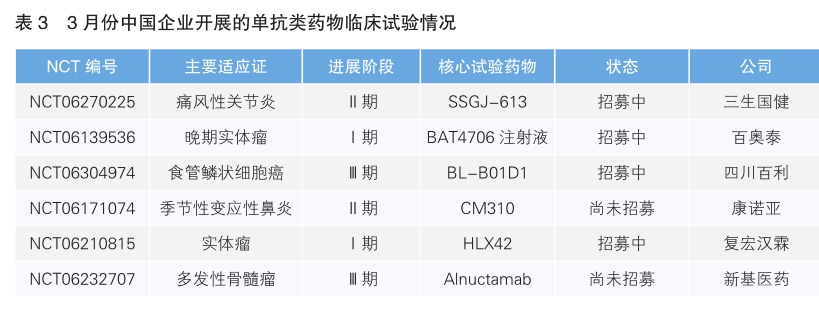
對快速增多的單克隆抗體類藥物的臨床試驗進行進一步檢索可知,當月開展該類臨床試驗最多的國家為美國,有14項;其次為中國,共有6條記錄。(詳見表3)
SSGJ-613是三生國健研發的具有全新可變區序列的抗IL-1β抗體。IL-1β屬于IL-1家族成員,是炎癥信號通路的關鍵分子,它不僅能發揮促炎作用,還可加強T淋巴細胞、B淋巴細胞的反應,因此是自身炎癥性疾病的重要治療靶點。SSGJ-613通過特異性結合IL-1β,能夠有效阻斷IL-1β介導的信號傳導,抑制其產生的炎癥效應,因此具有治療多種自身免疫性炎癥疾病的潛力。新開臨床試驗主要適應證為痛風性關節炎(NCT06270225,Ⅱ期)。
BAT4706是百奧泰開發的一項經無巖藻糖基化優化的IgG1類全人源單抗候選藥物,靶點為CTLA-4,用于治療晚期實體瘤(NCT06139536,Ⅰ期)。BAT4706能特異性結合CTLA-4分子,恢復T細胞的活化,同時其增強的抗體依賴性細胞毒性作用(ADCC)能導致腫瘤微環境的Tr egs凋亡,從而提高機體對癌癥的免疫反應。
BL-B01D1是由四川百利研發的一種新型EGFR/HER3雙抗抗體偶聯藥物(ADC),載荷為新型TOP1抑制劑ED04(基于拓撲異構酶的毒性物質,屬于一種喜樹堿類物質)。BLB01D1的單抗部分SI-B001針對EGFR和HER3兩個不同的靶點,更強的特異性增加了藥物的安全性;同時通過交聯作用促進兩個靶點的協同內吞,提高毒素進入腫瘤細胞的效率,并進一步通過減少受體蛋白在細胞膜上的表達量來抑制腫瘤細胞生長信號,實現更好的治療效果。新開臨床試驗主要適應證為食管鱗狀細胞癌(NCT06304974,Ⅲ期)。
司普奇拜單抗(CM310)是由康諾亞自主研發的一種高親和力的人源化抗體,專門針對I L-4Rα。這種抗體通過靶向IL-4Rα,雙重阻斷I L-4和I L-13對受體的活化,阻礙Ⅱ型炎癥的信號傳導途徑,從而治療與Ⅱ型炎癥相關的多種疾病,如特應性皮炎、哮喘、慢性鼻竇炎伴鼻息肉以及嗜酸性食管炎等。新開臨床試驗主要適應證為季節性變應性鼻炎(NCT06171074,Ⅱ期)。
HLX42是復宏漢霖研發的一款靶向表皮生長因子受體(EGFR)的新型ADC候選藥物,由高度特異性的人源化l gG1 EGFR抗體分子、可裂解的新型連接子-荷載毒素偶聯制備而成。HLX42的荷載毒素為一種新型DNA拓撲異構酶Ⅰ(Topoisomerase Ⅰ)小分子抑制劑,通過造成DNA雙鏈斷裂,阻斷DNA復制,從而導致腫瘤細胞凋亡。新開臨床試驗主要適應證為實體瘤(NCT06210815,Ⅰ期)。
Alnuctamab是新基醫藥開發的一種雙特異性T細胞接合劑(TCE),以獨特的2∶1方式同時結合表達b細胞成熟抗原(BCMA)的骨髓瘤細胞和T細胞(通過CD3)。這種相互作用旨在通過誘導T細胞活化和釋放促炎細胞因子和細胞溶解酶來驅動骨髓瘤細胞死亡。新開臨床試驗主要適應證為多發性骨髓瘤(NCT06232707,Ⅲ期)。
(數據來源于美國?Clinicaltrial?數據庫,標簽間存在統計重復,統計時間截至2024年4月15日)
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:陸悅)
右鍵點擊另存二維碼!
-
為你推薦