抗腫瘤藥物臨床試驗劑量選擇模式轉變
- 2023-12-19 09:14
- 作者:艾昆緯
- 來源:中國醫藥報
抗腫瘤藥物研發的劑量選擇模式正在經歷不同以往的根本性轉變。
傳統劑量選擇模式的目標是設定最大耐受劑量,這往往會造成額外的毒性,給受試者增加不必要的負擔。同時,分子靶向療法、免疫療法、細胞療法的劑量和治療方案常常在進行臨床試驗前未經充分描述,從而導致整個藥物研發過程的進一步低效。
為解決這一難題,美國食品藥品管理局(FDA)的腫瘤卓越中心設立了Optimus項目,并于2023年1月發布了新的指南草案《治療腫瘤疾病的人用處方藥物和生物制品的劑量優化》。該項目旨在推動藥物研發從以藥物為中心轉變為以患者為中心,更好地指導劑量選擇,并最大限度地改善患者結局。
傳統的劑量模式
癌癥是一種毀滅性的疾病,已經折磨人類千年之久,可是直到上個世紀,人類才研發出比較有效的治療方法來抗擊癌癥。20世紀40年代,氮芥問世,標志著人類為抗癌付出的努力迎來了希望曙光,開啟了為期50多年的由化療藥物推動的抗癌藥物研發模式。這種策略的基礎是,癌細胞在分裂和生長時缺乏調控,這意味著有細胞毒性的化學療法可以引發癌細胞損傷和殺死癌細胞。然而,這一治療方法會導致健康細胞同樣受到傷害,引起毒性反應。
為了平衡療效和安全性,醫生通常會按期開展化療,并設置間斷期。這些間斷不僅可以幫助患者緩解即時的副作用,也可以讓臨床醫生進一步控制和避免在治療結束后化療仍可能產生的長期毒性。
安全性指標是腫瘤學試驗的支柱,推動了研究者對最大耐受劑量的探尋。但是究竟由哪些因素構成了“劑量限制性毒性”?關于這個問題眾說紛紜,只能交由臨床醫生決定如何更好地權衡療效與風險。一些治療原則表明,療效與藥物功效和副作用均有關聯,這使得醫生難以作出決定。
抗癌藥物獲批后進行“劑量優化”時,往往要依靠后續臨床試驗和觀察數據來改善治療方案。例如,2018年公開的一項研究成果顯示,轉移性乳腺癌及卵巢癌患者的生存率降低可能與化療藥物劑量的調整有關,強調對于臨床試驗方案之外的劑量調整需要審慎思考。在多種靶向藥獲批后進行的上市后臨床試驗中,也進行過此類觀察。
劑量模式的轉變
如今,科學家對癌癥的理解已經深入了許多。過去,人們僅僅依靠有毒的化療藥物,并認為隨著劑量增加,療效也會增加,直到達到最大的毒性;現在,以特定的細胞途徑為靶標的新藥不斷被研發問世。研究發現,對于這些新療法來說,劑量與療效的關系與以前不盡相同。
例如,某個PI3K抑制劑藥物基于單臂試驗結果獲批上市,用于治療濾泡型淋巴瘤和慢性淋巴細胞白血病。在臨床試驗中,藥物劑量被設定為最大耐受劑量或者接近最大耐受劑量。然而,研究者在該藥物上市后隨訪研究中發現了過量毒性,并對總生存率產生了令人擔憂的影響,最終該藥物的前述適應證被撤銷。
近期,在一篇由FDA專家發表的文章中指出:“通過隨機‘劑量探尋’試驗來查明總體反應率與不良事件之間的關聯,就有可能避免選擇毒性過大的劑量以及由其導致的令人擔憂的療效和總體生存率。”同時,FDA建議,申辦者在啟動臨床試驗之前,需要先在隨機試驗中分析劑量反應關系并進行安全性評估。
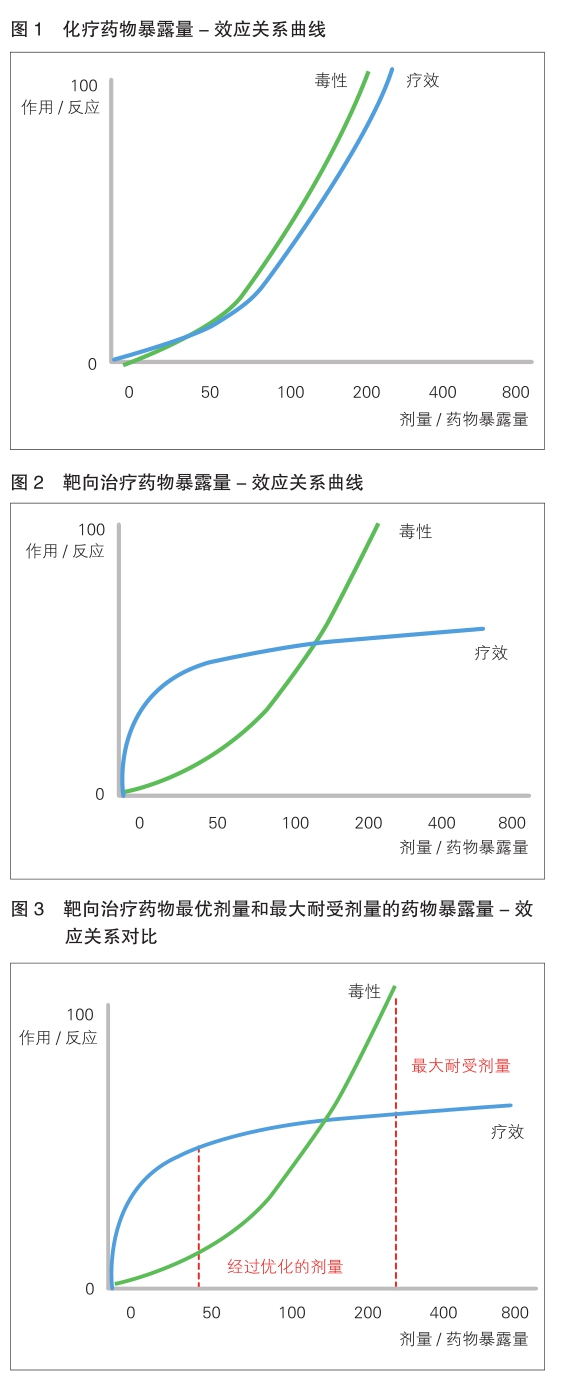
多年以來,傳統的有細胞毒性的化療一直堅持 “越多越好”的理念(詳見圖1)。可隨著時代的改變和多種新型療法的出現,檢測結果顯示,最優劑量可能遠低于最大耐受劑量,即具有相當的療效但毒性顯著降低。
如今,激酶抑制劑、單克隆抗體、抗體藥物偶聯物以及其它類型的療法呈現出不一樣的療效與毒性關系曲線,與傳統的曲線差異巨大(詳見圖2)。
隨著毒性的增加,通常會出現一個“療效平臺”,最優劑量可能遠低于最大耐受劑量(詳見圖3)。這些不同于以往的暴露-反應曲線特征是很多新型療法的劑量選擇標準需要改變的根本原因之一,有細胞毒性的化療藥物也是如此。
在早期試驗中納入更多數據
劑量對于藥物療效至關重要,FDA要求申辦方提供詳細的數據以便進行最優的選擇。為了滿足這些標準,申辦方必須根據血清樣本來識別藥代動力學的暴露量,并通過劑量調整或者根據治療引起的不良反應等,來關注耐受性方面的潛在風險。
此外,早期臨床試驗可能需要更多類型的數據,比如以下幾個方面的數據。
根據患者報告結局(PRO)得到的數據 在衛生健康評估中,患者反饋日益成為一種極具價值的資產,FDA已支持把患者報告結局用于藥品的上市審批。患者權益倡導者表示,中斷給藥或減少劑量會對患者生理健康造成負面影響,因為這會加重患者對于治療是否有效的焦慮,因此他們認為需要采用更可耐受的、更有益于健康的劑量。
在早期臨床試驗中,“劑量優化”是一個極具價值的步驟。提前把“患者報告結局”數據納入臨床試驗設計中,有利于找到更有效的劑量,在改善患者治療結果的同時又不會增加患者負擔。
其實,FDA在《治療腫瘤疾病的人用處方藥物和生物制品的劑量優化》中已經寫明:“患者報告結局可以系統、定量地評估可能的不良癥狀以及藥物對身體機能的影響。應考慮把患者報告結局納入進來,以完善早期‘劑量探尋’試驗中的耐受性評估。”
采用多個數據集進行建模和模擬 為了增加在試驗中成功找到最優劑量的機會,可以采用多個數據集進行建模和模擬,它們可以提供關鍵的見解,精準定位理想劑量。該做法的目標是盡可能提高總體反應率等療效指標,并評估“靶標抑制”和“受體占位”等來自PD生物標志物的輔助證據。如果有投資早期研發資源的可能,可以在“劑量擴展”之前采用“劑量優化”,這可以幫助申辦方盡早找到理想劑量,再根據其特有的作用機理擴展到不同的適應證。
與監管方進行早期溝通 為了確保藥物研發成功,申辦方必須與FDA和其他監管方進行有效溝通,詳細說明“劑量優化”設計,包括其關鍵終點。可以將“臨床前數據”作為依據,證明藥物適用于特定人群的適應證。申辦方還必須解釋說明這些“臨床前數據”。通過主動把“早期優化”納入其策略中,申辦方可以與監管機構持續對話,更快地達成共同期望的結果。
“劑量優化”以實現更好的臨床結果
過去,癌癥治療的目標是盡可能減少三級和四級毒性。現在則需要更精確的方法——能同時兼顧患者體驗和毒性水平。
采用精巧的ePRO(電子“患者報告結局”)評估工具可以幫助研究者實現這一點,它有助于微調劑量,同時也保證患者維持盡可能高的生活質量。
早期腫瘤學臨床試驗中推動“劑量優化”的基本因素之一是患者數量的增加。目前來看,申辦方很可能需要花更長的時間來招募這些患者。因此,申辦方必須準備好承擔額外的時間成本,或者想辦法讓更多患者參加這些早期試驗。
這也意味著申辦方需記住以下要素。
以患者為中心 為患者提供更便利的試驗選擇,這對于招募患者有一定作用,減輕參加者負擔則是其中的重要組成部分。如將需要患者長途跋涉來采集的用藥后PK樣品,改為讓他們輕松在家檢測,招募效果將大不相同。
增加入選患者的多樣性 申辦方可以通過盡早增加投資,擴大各類患者群體,來獲得有價值的安全性信息,這些安全性信息對于藥物將來的研發和注冊極具價值。
及早考慮復雜性 治療方案的另一難點在于,多種劑量強度需要在不同劑量級別的患者群中實現。部分“劑量優化”患者群會涉及到多種不同的療法,包括研究性產品和其它組合療法。所以,申辦方必須向患者科普他們所需的知識,讓患者安心,這樣患者才能正確、按時進行聯合治療。即使是一粒藥丸服用時間錯誤,都可能影響后果評估,干擾安全性信息的檢測。因此,有效的宣教輔助體系有利于順利開展工作。
綜上,隨著抗腫瘤藥物應該“更精確”的研發觀點的誕生,研究者明顯需要更穩健可靠、更有理有據的劑量選擇方法推動抗腫瘤藥物發展和進步,申辦方、患者和研究團隊等各方也都需要理解這種新模式的意義。 (艾昆緯供稿)
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:陸悅)
右鍵點擊另存二維碼!
-
為你推薦