外泌體:極具潛力的再生醫學技術及藥物遞送工具
- 2023-10-25 09:11
- 作者:吳夏?吳莎莎
- 來源:中國醫藥報
外泌體是一種40~160nm的細胞外囊泡,可由血細胞、免疫細胞、腫瘤細胞、干細胞等在內的幾乎所有類型的細胞分泌,并分布在各種體液中。外泌體是細胞間通訊的關鍵介質,及各種生理和病理過程中的功能介質。
研究發現,外泌體可以穿梭蛋白質、脂質、RNA和DNA等生物活性分子,且具有高生物利用度、生物穩定性、靶向特異性、低毒性和低免疫原性,使得外泌體在疾病診斷、治療及藥物遞送中極具潛力。
美國ClinicalTrials臨床試驗數據庫資料顯示,外泌體可作為肺癌、乳腺癌、結腸直腸癌等不同腫瘤的診斷生物標志物或治療藥物,還可作為藥物遞送系統、腫瘤疫苗;此外,外泌體還可用于再生醫學。然而,至今尚未有任何的外泌體療法批準上市,外泌體的臨床轉化仍面臨著諸多問題及挑戰。
外泌體發展歷程
外泌體是細胞外囊泡常見亞群之一。EV是由生物細胞分泌的納米級具有雙層膜結構的囊泡,是各種具有膜結構的囊泡的統稱,主要包括外泌體及微囊泡、微粒、外體、遷移體、腫瘤體和凋亡體等。現代研究證明,外泌體可影響腫瘤的各種生物學過程,包括細胞增殖、腫瘤轉移、血管生成、腫瘤耐藥和免疫反應等。
1981年,Trams等人從各種正常細胞和腫瘤細胞中培養出具有5′-核苷酸酶活性的脫落囊泡,囊泡的平均直徑為500~1000nm,并且通常含有直徑約40 nm的第二群囊泡,這是關于外泌體的最初描述。1983年,Harding等人和Pan等人分別在大鼠和綿羊網織紅細胞中,觀察到含有未降解的轉鐵蛋白受體與直徑約50 nm的小囊泡發生相互作用。隨后在1987年Johnstone將其正式命名為“外泌體”。
2013年,James E. Rot hman、Randy W. Schekman和Thomas C. Südhof三位科學家因發現并闡釋細胞囊泡運輸系統及調控機制而獲得諾貝爾生理學或醫學獎。
外泌體的組成及生理功能
外泌體含有DNA、RNA、mRNA、脂質、代謝物、細胞質和蛋白質等多種生物分子。研究顯示,目前已在外泌體中鑒定出9769種蛋白質、2838種miRNA、3408種mRNA和1116種脂質。其中,細胞膜常規的四跨膜蛋白(CD9、CD63、CD81等)、熱休克蛋白70(Hsc70)、溶酶體蛋白(Lamp2b)、腫瘤敏感基因101(Tsg101)、融合蛋白(CD9、flotillin,annexin)等蛋白在外泌體中的濃度較高,可作為外泌體鑒定的生物標志物。
近年來,研究發現血細胞、免疫細胞、腫瘤細胞、干細胞等在內的幾乎所有類型的細胞都可以產生外泌體,進行細胞間通訊,從而實現細胞增殖、分化、免疫調節、炎癥調控、細胞凋亡等多種生物學功能。
外泌體最初被認為是細胞用來排泄廢物的小泡,隨著研究的深入,發現外泌體可參與到機體免疫應答、抗原遞呈、細胞遷移、細胞分化、腫瘤侵襲等。
不同細胞來源的外泌體組成不同,其功能也不同。例如,樹突狀細胞分泌的外泌體具有MHC肽復合物,能夠激活T細胞,還可表達表面配體,如腫瘤壞死因子配體(TNF)、Fas配體(FasL)和TNF相關的凋亡誘導配體(TRAIL),從而和腫瘤細胞上的TNF受體結合,觸發半胱天冬酶活化和腫瘤凋亡。干細胞來源的外泌體包含與MSCs類似治療性的生長因子及mRNA等生物活性物質,具有免疫調節、組織修復等療效。癌細胞來源的外泌體能發揮免疫調節功能,導致免疫抑制或避免免疫反應。
外泌體的分離方法
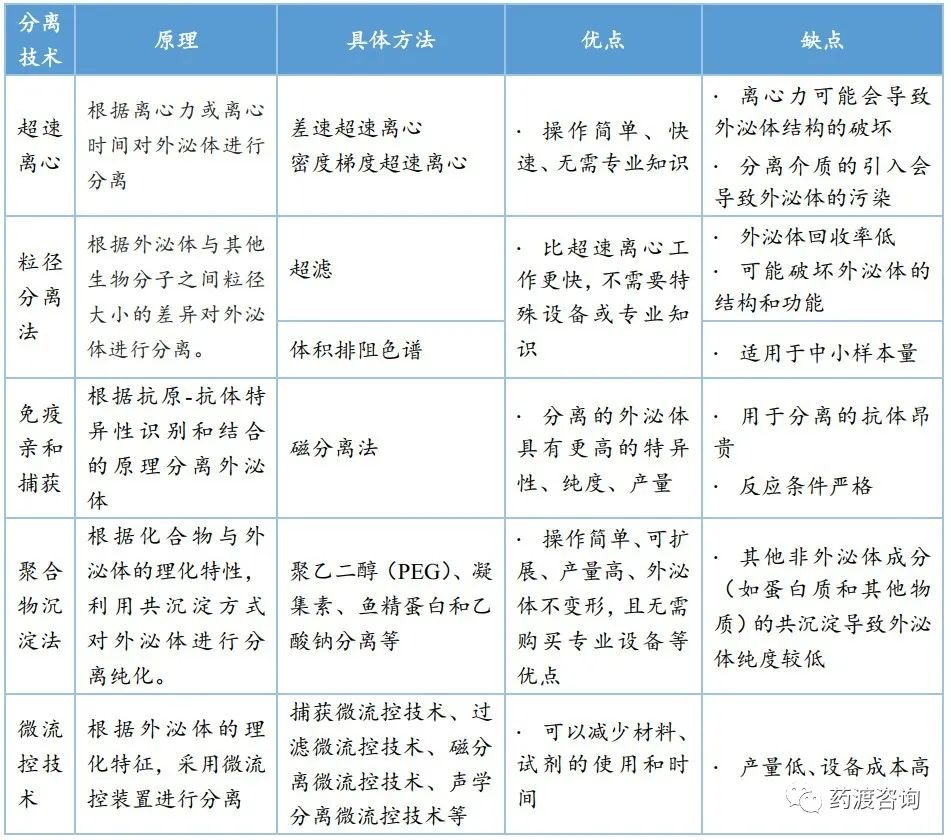
目前,研究人員已根據外泌體的大小、密度、表面電荷以及其表面相關的蛋白質開發了多種外泌體分離方法,主要包括超速離心、超濾、體積排阻色譜、免疫親和捕獲、聚合物沉淀法和微流控技術(各技術原理及優缺點見下表)。
由表1可知,外泌體分離方法已得到大量擴展,常用方法有差速超速離心、密度梯度離心法、沉淀法、過濾法、體積排阻色譜法以及免疫親和捕獲法等,其中差速超速離心仍是長期以來外泌體分離的“金標準”。然而,目前分離技術都存在一定缺陷,如何提高外泌體分離的純度、效率和質量仍是攻克外泌體分離技術難題的主要挑戰。
外泌體臨床應用
外泌體幾乎存在于所有的細胞、組織和體液中,是介導細胞間通訊的重要介質。研究認為,外泌體可通過與細胞膜直接融合,以及通過內吞途徑或配體-受體相互作用在細胞間通訊中發揮作用,從而參與到機體免疫應答、抗原遞呈、細胞遷移、細胞分化、腫瘤侵襲等。
目前,外泌體被廣泛用于生物標志物、藥物載體和疾病治療研究中。
藥物遞送系統
外泌體可通過內吞作用或經過囊泡和細胞膜的直接融合進入受體細胞,使其內容物輸送到細胞質中并引發功能反應。如來自抗原呈遞細胞(樹突狀細胞)的外泌體可以通過將負載肽的MHCⅠ類和Ⅱ類復合物轉移到T細胞,來調節免疫細胞反應。
外泌體作為一種潛在的藥物遞送系統,類似于脂質體,具有包裹親水核心的獨特雙脂膜,可裝載親水和親脂材料;由于外泌體具有不同脂質、表面蛋白、受體等,具有更好的組織和細胞靶向性;此外,外泌體由細胞自身產生,具有較好的生物相容性、低免疫原性和低毒性,可避免外源性的蛋白類、核酸類等藥物進入體內被免疫系統識別而遭到清除。目前,應用外泌體載藥的藥物類型主要為小分子化藥、核酸和蛋白質。
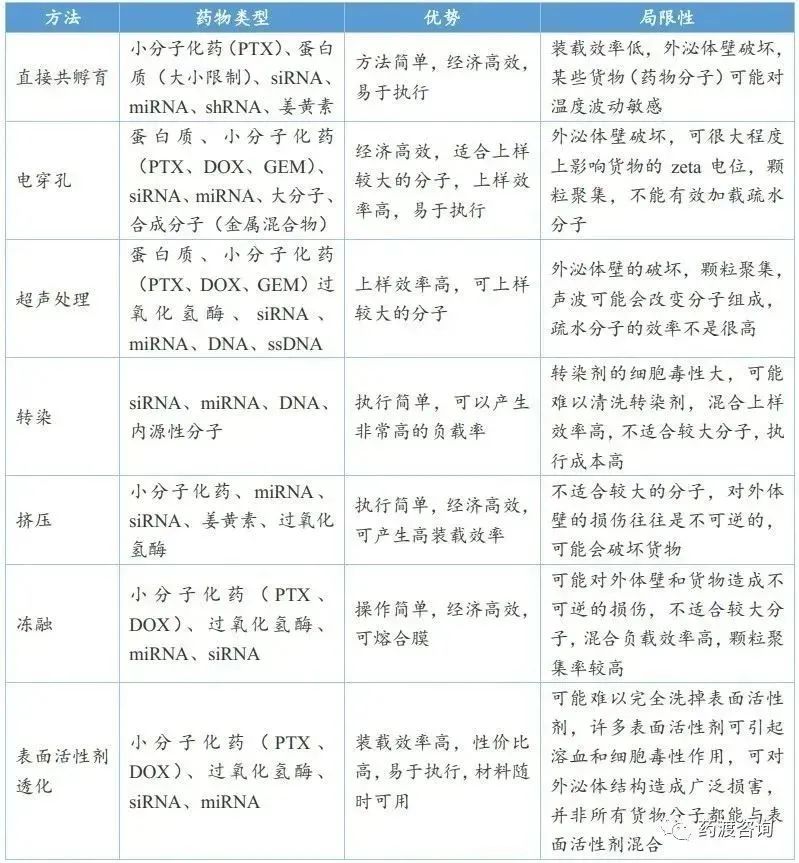
外泌體載藥方式可以分為外源性裝載(即外泌體分離后)和內源性裝載(即外泌體生物發生期間)兩種。
內源性裝載是在外泌體形成的生物過程中,通過直接轉染、共孵育等方法將目的藥物導入外泌體來源細胞,來源細胞再通過生物發生機制產生具有目的藥物的外泌體。目前,內源性裝載可裝載RNA、蛋白質、小核酸和小分子等不同類型藥物。
外源性裝載是通過電穿孔或脂質體轉染等方法將目的藥物導入分離后的外泌體中。目前,外源性裝載可裝載小分子化藥、蛋白質、多肽、核酸藥物、天然產物等,裝載藥物方式主要包括直接共孵育、電穿孔、超聲處理、轉染、擠壓、凍融、表面活性劑透化(詳見下表)。
診斷及預后標志物
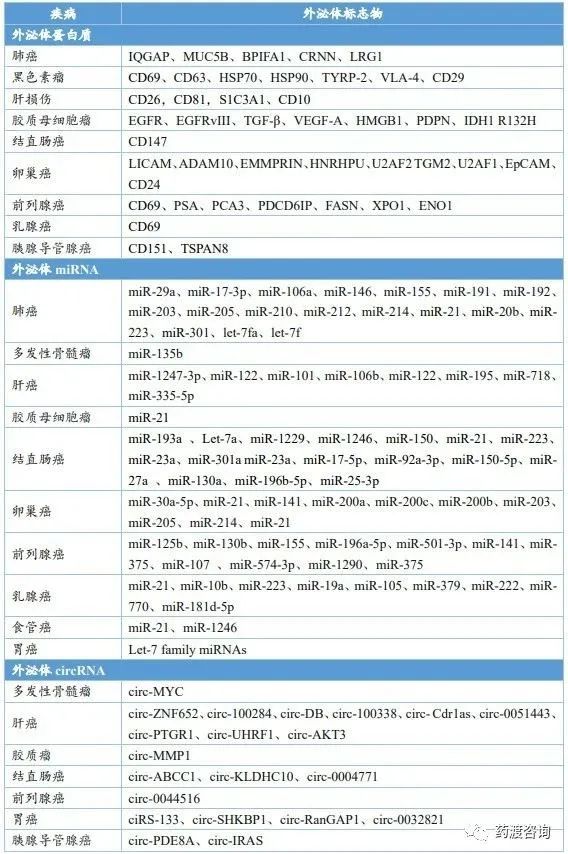
外泌體已被證明有望用作許多疾病的診斷和預后生物標志物,包括乳腺癌、泌尿道癌、肺癌、胃癌、肝癌、結直腸癌、卵巢癌等癌癥,以及帕金森病、阿茨海默病等中樞神經系統疾病,并且關于外泌體作為診斷工具的研究正在迅速擴展到其他疾病。
目前研究結果顯示,外泌體蛋白、miRNA、circRNA、l ncRNA均具有潛在的診斷和治療價值,如外泌體蛋白CD26、CD81、S1C3A1和CD10可用作為肝損傷潛在的生物標志,外泌體miR-21和miR-1246在乳腺癌患者中升高更為顯著,可作為乳腺癌的生物標志物。外泌體生物標志物與傳統生物標志物(血清、尿液等)相比,具有更高的靈敏度和特異性,以及更出色的穩定性。
疾病治療
近年來,研究證實外泌體對多種疾病具有治療潛力。例如,研究發現,外泌體可以穿過血腦屏障,作為炎癥反應和神經損傷再生的調節劑;從心球源細胞中分離的外泌體,當注射到缺血小鼠模型中時,可以抑制細胞凋亡并誘導心臟細胞的生長,等等。外泌體的治療作用基于其細胞內穿梭能力、穿越血腦屏障能力、低免疫原性、調節免疫系統以及增加或抑制炎癥的能力等。
與干細胞相比,外泌體在臨床治療的潛在優勢包括:無任何基于細胞的療法(包括干細胞)相關的固有風險;無復制潛力和惡性轉化的風險;可避免對感染和癌癥的免疫原性反應;可直接靶向目標組織或細胞。
外泌體臨床研究進展
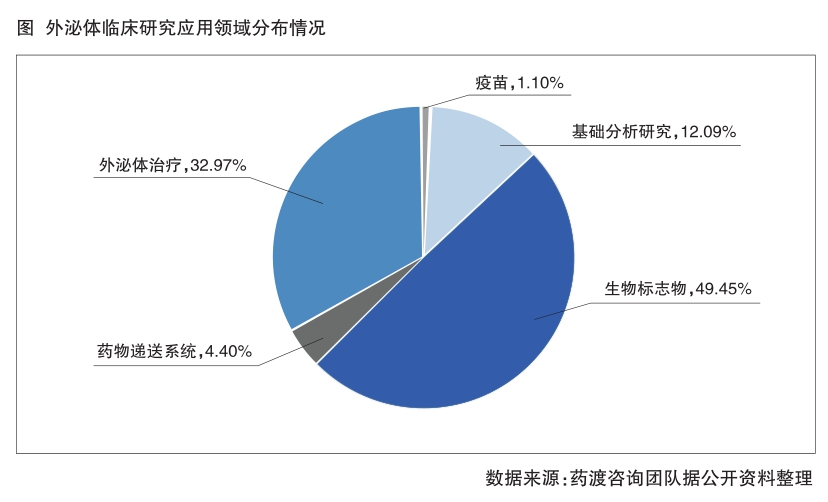
據美國ClinicalTrials數據庫資料顯示,截至2023年8月21日,ClinicalTrials共登記了182項關于外泌體的臨床研究,主要涉及外泌體生物標志物、外泌體治療、外泌體藥物遞送系統。
182項外泌體領域的臨床研究中,有90項(49.45%)是關于生物標志物的應用,59項(32.97%)為外泌體治療藥物研究,8項(4.40%)關于藥物遞送系統,22項(12.09%)屬于外泌體基礎分析研究;此外,疫苗類臨床研究有3項(1.10%)(詳見圖)。
上述59項外泌體治療藥物的臨床研究中,可明確臨床試驗階段的有46項。其中,Ⅰ/Ⅱ期臨床試驗最多(16項),其次為Ⅰ期(10項),Ⅲ期臨床試驗最少(2項),Ⅱ/Ⅲ期臨床試驗有3項。
兩項Ⅲ期臨床試驗涉及兩款外泌體產品,分別為CAP-1002、Bone Marrow Mesenchymal Stem Cell Derived Extracellular Vesicles。
CAP-1002是由Capricor Therapeutics Inc研發的一種基于外泌體的細胞療法,擬開發適應證包括X連鎖遺傳病、杜氏肌營養不良癥、肌病、肌肉萎縮性疾病、肌營養不良、神經肌肉疾病和遺傳病。
Bone Marrow Mesenchymal Stem Cell Derived Extracellular Vesicles是由Direct Biologics研發的一種骨髓間充質干細胞衍生的細胞外囊泡療法,擬開發適應證包括成人呼吸窘迫綜合征、克羅恩病、潰瘍性結腸炎等。
外泌體領域代表企業
外泌體自被發現以來,已歷經40余年發展,全球布局外泌體領域的企業數量及規模也在不斷增長。據公開資料統計,近50家外泌體Biotech公司的研發方向主要聚焦在腫瘤(30%)、腦部疾病(16%)、肺部疾病(7%)、皮膚病(5%)、疫苗開發(13%)、醫美修護(8%)、肝臟疾病(5%)、腎臟疾病(3%)以及基因治療/罕見病(13%)等領域。
以下是布局外泌體領域的代表性企業情況。
Aethlon Medical
Aethlon Medical成立于1999年,是一家上市醫療器械公司,專注于開發腫瘤、傳染性疾病及其他一些威脅生命疾病領域的創新醫療設備。
Aethlon核心產品Hemopurifier是一款血液凈化器,可快速消除促癌外泌體和循環病毒。美國食品藥品管理局(FDA)已批準Hemopurifier 為突破性設備,用于治療對標準治療無反應或不耐受的晚期或轉移性癌癥患者,以及外泌體已被證明參與疾病進展或嚴重的癌癥患者,以及尚無獲批治療藥物的危及生命的病毒。
Aethlon控股子公司Exosome Sciences成立于2017年,致力于開發外泌體生物標志物,以診斷、監測腫瘤及神經系統疾病。目前正在推進開發TauSomeTM生物標志物,作為診斷活體個體慢性創傷性腦病候選血液測試的基礎。
Celularity
Celularity成立于2017年,是一家臨床階段生物技術公司,致力于開發胎盤來源的同種異體細胞療法和外泌體。細胞療法包括未經修飾及基因修飾的NK細胞、工程化T細胞(CAR-T細胞)、間充質樣貼壁基質細胞。
該公司開發胎盤外泌體(pEXO)作為潛在的治療方法,可以提供促再生因子,促進神經細胞、血管和肌肉的發育。目前,該公司外泌體產品管線有1款處于啟動新藥臨床試驗(IND)階段。
Codiak Biosciences
Codiak Biosciences是一家成立于2015年的生物技術公司,也是外泌體領域第一家上市公司,專注于開發基于外泌體的新型藥物療法。
Codiak開發了其專有的engExTM平臺,以擴展外泌體的固有特性,設計、工程和制造新的外泌體治療候選藥物。Codiak曾利用engExTM平臺開發了一系列工程外泌體,旨在治療廣泛領域的疾病,包括腫瘤學、神經腫瘤學、神經病學、神經肌肉疾病和傳染病等。
然而,Codiak于今年3月29日自愿向美國特拉華州破產法院申請破產保護,出售資產。
Evox Therapeutics
Evox Therapeutics成立于2016年,是一家臨床前階段生物技術公司,致力于開發基于外泌體的創新療法來治療罕見病和嚴重疾病。
外泌體藥物可解決基于蛋白質、抗體和核酸療法的一些局限性,使其能夠遞送到目前通過常規手段無法到達的細胞和組織。Evox開發了其專有技術平臺DeliverEXTM,可利用各種分子工程、藥物裝載和靶向策略來修飾外泌體,以促進靶向藥物遞送到感興趣的器官,如大腦和中樞神經系統。
目前,Evox正在開發一系列基于外泌體遞送的候選藥物,包括針對成人及兒童苯丙酮尿癥的外泌體遞送的編碼苯丙氨酸羥化酶(PAH)的AAV(腺相關病毒),以及針對神經退行性疾病的外泌體遞送的siRNA藥物等。
Xsome Biotech
Xsome Biotech成立于2021年,是一家臨床前階段生物技術公司,致力于開發用于多種疾病的外泌體療法和新型藥物遞送載體。
Xsome建立了外泌體再生醫學及工程化外泌體藥物遞送平臺。外泌體再生醫學平臺利用肺球細胞來源的天然外泌體,開發治療肺部疾病候選外泌體療法產品;工程化外泌體藥物遞送平臺利用HEK293細胞外泌體裝載mRNA、重組蛋白、小分子藥物等,以治療腫瘤、特發性肺纖維化及罕見病等。
目前,Xsome核心候選藥物XO101已獲得美國FDA的IND許可,用于治療COVID19-ARDS患者;肺球細胞衍生的外泌體候選藥物XSO201,也正在準備申報IND。
臨床開發面臨的主要問題
外泌體在疾病診斷、治療以及藥物遞送方面的作用已眾所周知。然而,從實驗室到臨床的轉化仍然存在各種挑戰。
缺乏規模化制備及標準化方法
外泌體廣泛存在于各種體液中,可以從各種類型的細胞中分離出來,不同來源的外泌體,其組成也可能不同。目前根據外泌體的尺寸、理化特性已建立了多種外泌體分離方法,但至今最純凈的外泌體是利用蔗糖或碘沙醇通過密度梯度分離方法分離的,然而這種方法耗時長、成本高。其他方法如“金標準”差速超速離心法的設備昂貴,且離心力可能會破壞外泌體的結構和功能;微流控技術分離同樣存在設備昂貴、產量低的問題。可見,現有外泌體的分離技術無法滿足外泌體規模化制備的需求。
此外,缺乏標準化的生產方案,可能導致每批次間產品的差異,從而影響治療效果。
外泌體藥物相關標準不完善
目前,在外泌體的分離與鑒定、質量控制等環節尚缺乏統一標準,已生產或正在生產中的外泌體也無完整的審批標準。
在我國,近兩年相關研究單位相繼制定了多項關于人多能干細胞、人間充質干細胞來源的細胞外囊泡的團體標準,包括《人多能干細胞來源的小細胞外囊泡》(T/CRHA 002-2021)、《人間充質干細胞來源的小細胞外囊泡》(T/CRHA 001-2021)、《人干細胞來源細胞外囊泡制備通用要求》(T/CSCB 0007-2022),以進一步推動并規范外泌體行業的發展。
然而,現有標準的指導性仍不足。未來若國內企業申報外泌體產品IND,可能需要與藥監部門進行大量溝通,IND申報材料和內容可能要大量修改。
缺乏權威第三方檢測專業機構
依據我國藥品監管規定,新藥在申報IND時,均應經過專業第三方檢測機構標準符合性檢驗合格。然而,目前中國食品藥品檢定研究院及其他專業檢測機構尚未對外泌體檢驗檢測建立標準。
監管亟待完善
目前,全球范圍內已有超過100多家企業或私人診所直接向消費者銷售基于干細胞外泌體的新藥物,其中約30%的企業位于美國。美國FDA曾于2019年12月6日發布關于外泌體產品的公共安全通知,以規范外泌體的上游生產步驟,但仍存在企業直接向消費者提供未經證實的外泌體療法的情況。
盡管面臨諸多挑戰,但外泌體憑借其天然形成機制,以及包含大量多樣活性生物分子的特殊結構,可以承載多元化的臨床價值,在腫瘤治療、細胞替代治療、再生醫學、藥物載體、科研模型等方面顯示了巨大應用潛力。相信隨著技術的突破,外泌體將會迎來跨越式發展。
(藥渡咨詢 吳夏?吳莎莎)
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:陸悅)
右鍵點擊另存二維碼!
-
為你推薦