每周醫藥看點(5.8~5.14)
- 2021-05-17 09:17
- 作者:陸悅
- 來源:中國食品藥品網
中國食品藥品網訊 習近平總書記在河南南陽考察時指出,要發展中醫藥,注重用現代科學解讀中醫藥學原理,走中西醫結合的道路;國務院辦公廳印發《關于全面加強藥品監管能力建設的實施意見》;國家藥監局發布《藥物警戒質量管理規范》;第五批國家藥品帶量采購工作正式啟動……5月8日~5月14日,醫藥行業的這些事情值得關注。
行業政策動態:
1、5月12日下午,正在河南省南陽市考察的習近平總書記先后來到醫圣祠和南陽藥益寶艾草制品有限公司,了解中醫藥發展和艾草制品產業發展情況。習近平說,過去,中華民族幾千年都是靠中醫藥治病救人。特別是經過抗擊新冠肺炎疫情、非典等重大傳染病之后,我們對中醫藥的作用有了更深的認識。我們要發展中醫藥,注重用現代科學解讀中醫藥學原理,走中西醫結合的道路。
2、國務院辦公廳印發《關于全面加強藥品監管能力建設的實施意見》。文件明確了六個方面重點工作:完善法規和標準體系建設;提高審評能力,優化審評機制;完善檢查執法體系和辦案機制,強化部門協同;提高檢驗檢測能力,完善應急管理體系;完善信息化追溯體系,提升“互聯網+藥品監管”應用服務水平;實施中國藥品監管科學行動計劃,提升監管隊伍素質和監管國際化水平。
3、國家醫保局、國家衛生健康委發布《關于建立完善國家醫保談判藥品“雙通道”管理機制的指導意見》,從分類管理、遴選藥店、規范使用、完善支付政策、優化經辦管理等方面,對談判藥品“雙通道”管理提出了要求。
“雙通道”是指通過定點醫療機構和定點零售藥店兩個渠道,滿足談判藥品供應保障、臨床使用等方面的合理需求,并同步納入醫保支付的機制。文件明確,綜合考慮臨床價值、患者合理的用藥需求等因素,對談判藥品施行分類管理。對于臨床價值高、患者急需、替代性不高的品種,要及時納入“雙通道”管理。將談判藥品“雙通道”供應保障情況納入定點醫藥機構協議管理范圍,明確藥品供應主體和責任,督促定點醫療機構按功能定位和臨床需求及時配備,定點零售藥店按供應能力和協議要求規范配備。各地醫保部門要確定遴選標準和程序,將資質合規、管理規范、信譽良好、布局合理,并且滿足對所售藥品已實現電子追溯等條件的定點零售藥店納入“雙通道”管理。
4、國務院同意在河南省開展跨境電子商務零售進口藥品試點,試點期為自批復之日起3年。試點品種為已取得我國境內上市許可的13個非處方藥,試點目錄由財政部、商務部、海關總署、稅務總局、市場監管總局、國家藥監局等部門聯合印發。對納入試點目錄的藥品,按照《關于跨境電子商務零售進出口商品有關監管事宜的公告》規定的通關管理要求開展進口業務,在通關環節不驗核進口藥品通關單,參照執行跨境電商零售進口相關稅收政策,相關交易納入個人年度交易總額管理,適用跨境電商零售進口商品單次、年度交易限值相關規定,在交易限值內,關稅稅率暫設為0%,進口環節增值稅、消費稅暫按法定應納稅額的70%征收。
5、公安部、國家衛生健康委和國家藥監局聯合發布公告,決定正式整類列管合成大麻素類新精神活性物質,并新增列管氟胺酮等18種新精神活性物質。公告自2021年7月1日起施行。我國將成為全球第一個對合成大麻素類物質實行整類列管的國家。
相關主管部門將制定合成大麻素等列管新精神活性物質檢驗鑒定公共安全行業標準,推進基于可疑物質和譜圖分析的新精神活性物質監測體系建設,建立符合中國國情的合成大麻素等新精神活性物質成癮性和危害性快速評估體系。
6、商務部、國家中醫藥管理局等7部門聯合印發《關于支持國家中醫藥服務出口基地高質量發展若干措施的通知》,從完善體制機制、創新支持政策、提升便利化水平、拓展國際合作空間、加強人才培養和激勵等五方面,提出18條具體政策措施,著力完善發展環境,形成部門政策合力,支持國家中醫藥服務出口基地大力發展中醫藥服務貿易,推動中醫藥服務走向世界。
目前,商務部會同國家中醫藥管理局認定了中國中醫科學院廣安門醫院等17家國家中醫藥服務出口基地。
法規/標準/技術文件/說明書制修訂:
1、國家藥監局發布《藥物警戒質量管理規范》(以下簡稱《規范》),自2021年12月1日起施行。《規范》共九章一百三十四條。明確藥品上市許可持有人(以下簡稱持有人)和獲準開展藥物臨床試驗的藥品注冊申請人(以下簡稱申辦者)應當建立藥物警戒體系,通過體系的有效運行和維護,監測、識別、評估和控制藥品不良反應及其他與用藥有關的有害反應;應當基于藥品安全性特征開展藥物警戒活動,最大限度地降低藥品安全風險,保護和促進公眾健康;應當與醫療機構、藥品生產企業、藥品經營企業、藥物臨床試驗機構等協同開展藥物警戒活動。對持有人和申辦者實施藥物警戒活動作出規定,涉及質量管理、機構人員與資源、監測與報告、風險識別與評估、風險控制、臨床試驗期間藥物警戒等方面,明確了對藥物警戒體系及活動進行質量管理、不良反應信息的監測與報告、委托開展藥物警戒相關工作的相關要求。
2、國家藥監局發布《醫療器械分類目錄動態調整工作程序》,明確《醫療器械分類目錄》動態調整原則和調整種類、調整建議提出方式和材料要求及調整意見審定的工作程序等內容。文件自公布之日起實施。
3、國家藥監局發布《醫療器械臨床試驗質量管理規范(修訂草案征求意見稿)》并公開征求意見,意見反饋截止時間為5月30日。該文件對現行《醫療器械臨床試驗質量管理規范》(以下簡稱《規范》)整體框架作出調整,修訂為總則、倫理委員會、醫療器械臨床試驗機構、研究者職責、申辦者職責、臨床試驗方案和試驗報告、多中心臨床試驗、記錄要求、術語9章66條;文件還將體外診斷試劑臨床試驗質量管理要求納入規范管理,明確了醫療器械臨床試驗相關方責任。
4、國家藥監局發布《牙科玻璃離子水門汀注冊技術審查指導原則》《檸檬酸消毒液注冊技術審查指導原則》《一次性使用注射筆配套用針注冊技術審查指導原則》《一次性使用無菌閉合夾注冊技術審查指導原則》,分別從綜述資料、研究資料、生產制造信息、產品風險分析資料、產品臨床評價等方面對相關產品的注冊申報資料要求進行規范指導。
5、國家藥監局對消炎鎮痛膏、安神補腦制劑、清開靈口服制劑三類產品的說明書予以修訂。
6、國家藥監局藥品審評中心(CDE)發布《每日一次基礎胰島素生物類似藥臨床研究設計指導原則(征求意見稿)》《化學藥品和治療用生物制品說明書中兒童用藥相關信息撰寫的技術指導原則(征求意見稿)》《急性非靜脈曲張性上消化道出血治療藥物臨床試驗技術指導原則(征求意見稿)》,向社會公開征求意見。
7、國家藥典委公示12個中藥飲片品種炮制規范草案,包括牽牛子、炒牽牛子、南五味子、醋南五味子、芡實、炒蔓荊子、青皮、山楂、青葙子、醋青皮、炒山楂、焦山楂;公示3個國家藥品標準草案,包括硫酸鋅、碳酸鈣D3咀嚼片(Ⅱ)、碳酸鈣D3咀嚼片(IV);并第二次公示大豆油(供注射用)(原料)國家藥品標準草案。上述公示期均自發布之日起3個月。
8、中國食品藥品檢定研究院完成13個注冊檢驗用體外診斷試劑國家標準品和參考品的研制,并對其說明書予以公示。公示的國家參考品包括:EB病毒核酸檢測試劑、副流感病毒核酸檢測試劑、呼吸道合胞病毒核酸檢測試劑、呼吸道腺病毒核酸檢測試劑、諾卡菌核酸檢測試劑、黃熱病毒核酸檢測試劑、森林腦炎病毒核酸檢測試劑、西尼羅病毒核酸檢測試劑、乙型腦炎病毒核酸檢測試劑、炭疽桿菌核酸檢測試劑。國家標準品包括:副流感病毒核酸檢測試劑、呼吸道合胞病毒核酸檢測試劑、呼吸道腺病毒核酸檢測試劑。
產品研發/上市信息
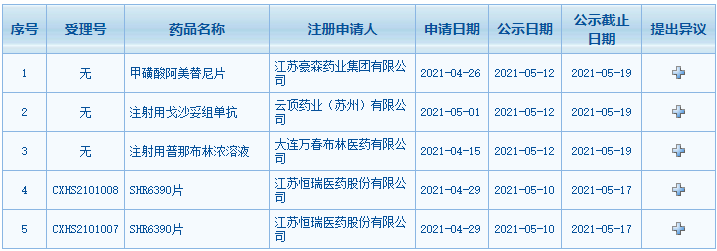
1、國家藥監局發布4期藥品批準證明文件待領信息,共包括258個受理號。(截至5月14日)
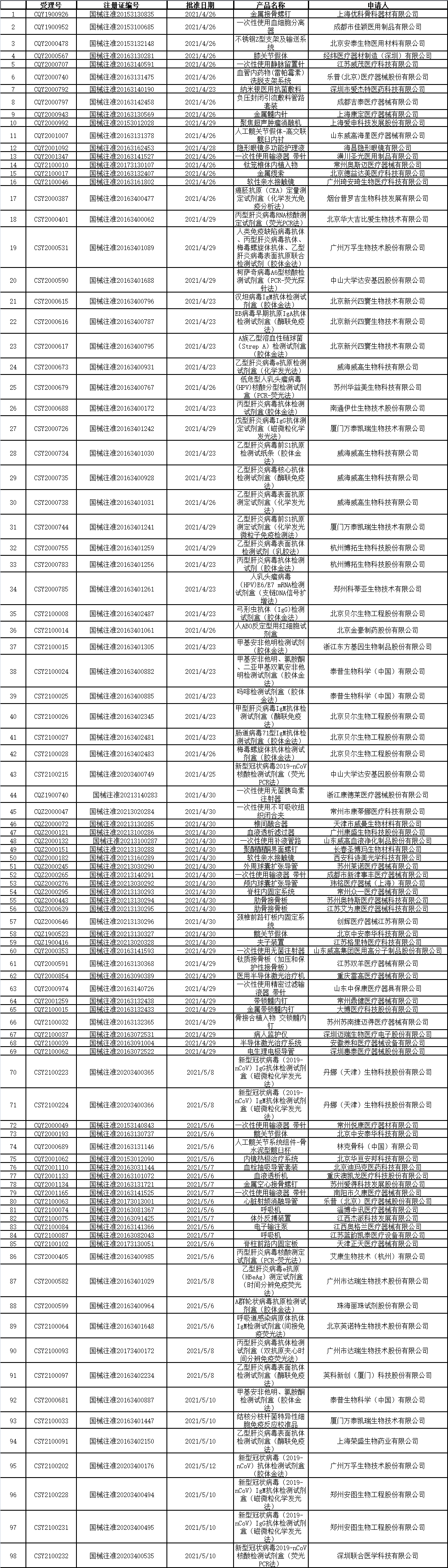
2、國家藥監局發布5期醫療器械批準證明文件(準產)待領信息,共包括98個受理號。(截至5月14日)
3、CDE承辦受理47個新藥上市申請,其中包括1.1類中藥顱通膠囊,苯乙基異硫氰酸酯液體硬膠囊等1類化學藥,以及派安普利單抗、澤貝妥單抗、重組人源化抗Trop2單抗-SN38偶聯物片等1類治療用生物制品。(截至5月14日)
4、CDE網站公示5個擬優先審評品種。其中包括:注射用普那布林濃溶液,該藥適應證為:與聚乙二醇化重組人粒細胞刺激因子聯合應用,適用于成年非髓性惡性腫瘤患者化療導致的中性粒細胞減少癥(CIN),于2020年9月被納入“突破性治療品種”;戈沙妥組單抗,該藥適應證為:用于治療接受過至少2線既往治療的轉移性三陰性乳腺癌(TNBC)成人患者。(截至5月14日)
5、國家藥監局醫療器械技術審評中心公示醫療器械優先審批申請審核結果,分枝桿菌鑒定試劑盒(熒光PCR熔解曲線法)屬于“被列入國家科技重大專項的醫療器械”,擬定予以優先審批。
醫藥企業觀察:
1、復星醫藥披露公告,公司控股子公司復星醫藥產業擬與BioNTech(拜恩泰科)投資設立合資公司,以實現mRNA新冠疫苗產品的本地化生產及商業化。
2、日本住友制藥會社中國子公司住友制藥(蘇州)有限公司和侖勝醫藥簽訂資產轉讓協議,侖勝醫藥將其與愛爾蘭公司Nabriva Therapeutics DAC簽署的lefamulin相關的許可協議等轉讓給住友制藥。住友制藥將獲得lefamulin在中國的獨家研發和銷售權。與此同時,住友制藥還將獲得侖勝醫藥持有的Gemtesa(vibegron)、RVT-802、rodatristat ethyl在中國等的權益。
3、恒瑞醫藥公告,旗下卡瑞利珠單抗獲國家藥監局批準新適應證臨床,用于治療三陰性乳腺癌。
4、海正藥業公告,旗下注射用達托霉素在美國提交的新藥簡略申請(ANDA)已獲得FDA批準,該藥將在美國市場銷售。
5、Galmed Pharmaceuticals Ltd.宣布,旗下產品Aramchol(花生酰氨基膽酸)在中國提交的新藥臨床試驗申請(IND)已獲國家藥監局批準,用于治療非酒精性脂肪性肝炎(NASH)和纖維化的III期ARMOR研究。
6、康方生物科技(開曼)有限公司宣布,其自主研發的新型腫瘤免疫治療藥物PD-1/VEGF雙特異性抗體(研發代號:AK112)已完成在中國及澳大利亞等國家開展的劑量爬坡和擴展的I期臨床研究,將繼續開展多項單藥或聯合用藥的臨床研究,包括:單藥治療晚期非小細胞肺癌;單藥治療復發/轉移性婦科腫瘤;聯合化療治療晚期非小細胞肺癌,包含一線、PD-1/L1抑制劑治療失敗及酪氨酸激酶抑制劑(TKI)治療失敗的隊列;聯合化療一線治療廣泛期小細胞肺癌;聯合PARP抑制劑治療BRCA基因野生型鉑敏感復發性卵巢癌。
7、上海君實生物公告,旗下JS103注射液針對痛風適應證的臨床試驗申請獲得國家藥監局批準。
8、綠葉制藥發布公告稱,旗下2類新藥鹽酸羅哌卡因脂質體混懸注射液(LY09606)已獲得CDE批準開展臨床試驗。
9、聯拓生物與NANOBIOTIX宣布,雙方就NANOBIOTIX旗下潛在首創性放射增強劑NBTXR3達成合作伙伴關系。根據協議,聯拓生物將獲得在大中華區、韓國、新加坡和泰國開發和商業化NBTXR3的獨家授權;而NANOBIOTIX將獲得2000萬美元的首付款,最高可達2.2億美元潛在的開發和商業化里程碑付款,以及NBTXR3在授權區域內的凈銷售分成。
10、上海睿昂基因科技股份有限公司(睿昂基因)發布招股說明書,宣布首次公開發行股票并在科創板上市。本次擬公開發行1,390.00萬股,每股發行價格18.42元。
11、凱聯醫療科技(上海)有限公司(凱聯醫療)完成逾億元C輪融資。本輪融資由東方富海領投,乾道投資基金及現有股東斯道資本跟投,銳翎資本作為FA協助凱聯醫療本輪融資工作。
12、國家市場監督管理總局反壟斷局發布信息通報:英國競爭與市場管理局(CMA)對葛蘭素史克等公司反向支付行為予以處罰。通報表示英國競爭上訴法庭當日判決維持CMA對葛蘭素史克公司和部分仿制藥供應商違反競爭法的認定,但將CMA原來確定的罰款金額減少2,710萬英鎊:葛蘭素史克公司的總罰款為37,606,275英鎊;關于GenericsUK的違法行為,對默克公司(MerckKGaA,GenericsUK的前母公司)和GenericsUK處以5,841,286英鎊的罰款;關于Alpharma的違法行為,對ActavisUKLimited,XelliaPharmaceutricalsApS和AlpharmaLLC處以總計1,542,860英鎊的罰款。
藥械集中采購
1、上海陽光醫藥采購網發布《關于開展第五批國家組織藥品集中采購相關藥品信息收集工作的通知》,第五批國家藥品帶量采購工作正式啟動。此次公布的國采藥品申報范圍涉及60個品種共計202個品規,品種和品規數均為歷次帶量集采之最。
本次入圍藥品包括抗腫瘤藥物、消化制劑、抗生素、呼吸、吸入制劑、造影劑、糖尿病藥物、眼科用藥、抗病毒用藥等。
2、山東省公共資源交易中心發布《關于第四批國家組織藥品集中采購山東中選產品掛網執行等事宜的通知》,根據第四批國家組織藥品集中采購山東中選結果落地執行的工作部署,就建立配送關系、平臺調整價格等事宜進行通知。
3、寧夏公共資源交易服務中心發布《關于公布2021年寧夏回族自治區(一季度)藥品陽光掛網結果的通知》,對藥品陽光掛網(一季度)無異議的899個藥品予以公布。(中國食品藥品網陸悅 整理)
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:陸悅)
右鍵點擊另存二維碼!
-
為你推薦