前沿新知 | 藥物研發新革命——核磁共振技術加速先導化合物發現
- 2021-01-25 15:08
- 作者:潘峻、趙琨
- 來源:藥渡
帶磁性的核在外加磁場中會產生能級裂分,吸收對應波長的電磁波就會發生能級的躍遷,停止電磁波照射后通過自旋晶格弛豫回到平衡態,產生核磁共振效應。經過核磁共振科學家多年不懈的努力后,二維核磁技術終于在20世紀70年代開始走向成熟,走向應用,典型的有同核COSY、DQF-COSY、TOESY、NOESY、ROESY技術,異核HMQC、HMSC、HSQC技術,另外還有研究核與核之間相互作用的NOE技術[1]。新藥發現的一個主要途徑是化合物文庫和天然化合物的的篩選以及為了活性性質優化的大量結構類似化合物的合成。這些過程耗費大量人力物力,且風險很高,而這些技術為研究蛋白質的結構和小分子與蛋白質之間的相互作用帶來了極大的便利。從20世紀末核磁共振技術首次成功運用于先導化合物的發現過程開始,一場新的藥物發現技術革命悄然誕生。
FK506結合蛋白抑制劑先導化合物的發現[2]
FK506結合蛋白和FK506結合,抑制鈣調磷酸酶和阻止T細胞活化,為了尋找FK506和結合蛋白結合的抑制劑,Fesik等人避開了傳統的篩選路徑,開發了一套嶄新的藥物先導化合物篩選發現途徑,具體總結過程如下圖所示:
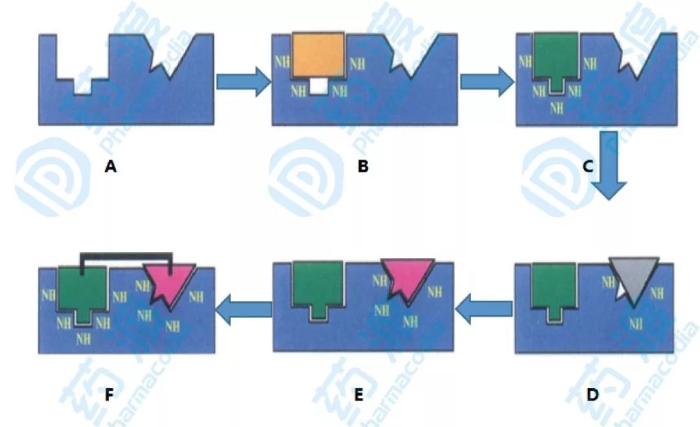
圖1.基于核磁共振技術的分子設計步驟示意圖
上圖A是靶標蛋白的三維結構,通過第一輪小分子化合物配體篩選得到B,小分子與蛋白的結合作用可以通過N同位素標記的HSQC技術觀察酰胺質子和氮原子的化學位移來識別,由于蛋白是N同位素標記,而化合物沒有進行N同位素標記所以小分子底物不會干擾蛋白化學位移信號,從而提高了信噪比。第一個配體得到后經過一系列的藥物化學修飾得到優化后的C,下面的目標則是尋找結合蛋白相鄰位點的配體,確定的依據仍是核磁譜圖中化學位移變化的相關情況,第二個配體粗選后繼續經過藥物化學的修飾得到活性最高的小分子化合物如上圖E。在兩個先導配體被選定后,通過核磁共振或者X-射線衍射技術得到三元復合物在空間的相對位置和小分子配體的空間取向,通過設計合適的連接子將兩個配體片段連接起來得到最后的先導化合物上圖F。
在FK506結合蛋白的抑制劑篩選過程中,第一輪篩選發現化合物文庫發現如下圖化合物1具有最高的活性,化合物1不經過進一輪的優化作為第一個配體,可以通過酰胺化學位移的變化斷定化合物1的結合位置和FK506哌啶酸部分的結合位置一致。在化合物1飽和的條件下,繼續尋找與相鄰結合位點結合的小分子配體,通過對化合物庫的篩選初步得到化合物2具有一定的活性,通過對在化合物1飽和的情況下化合物2加入后化學位移的變化,可以斷定化合物2和化合物1的結合位點相近。
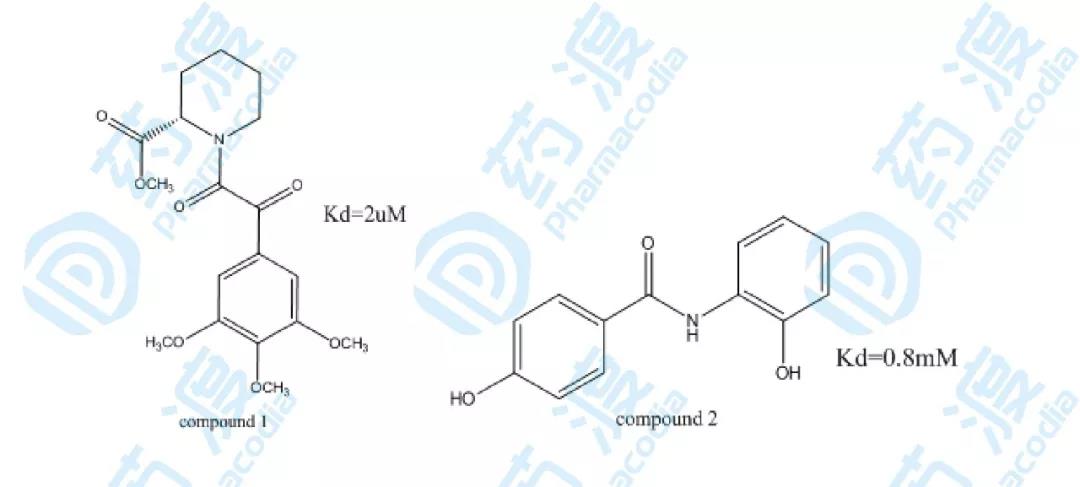
圖2.化合物1和2的結構圖
化合物2經過經過進一輪的構效關系研究得到最終高活性的化合物3。
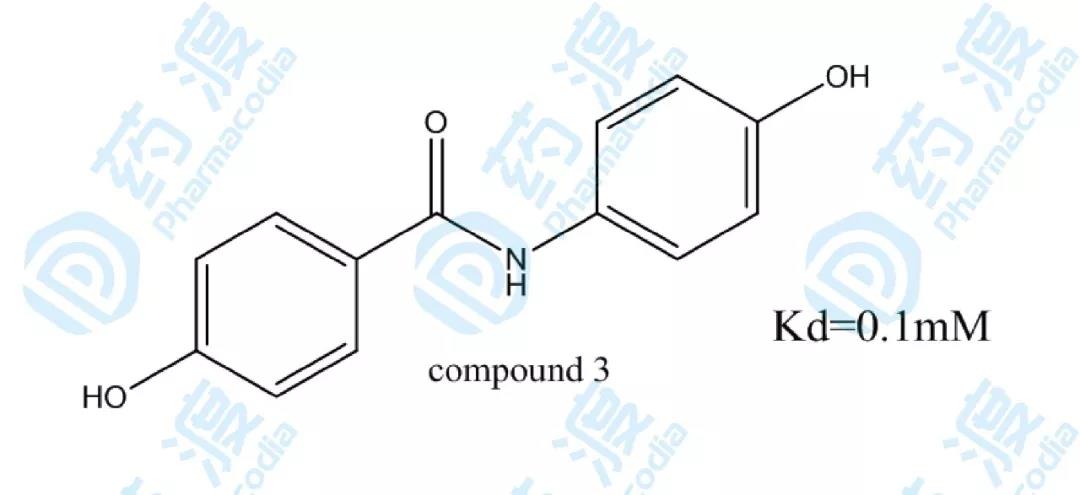
圖3.化合物3的結構圖
通過基于同位素濾波核磁共振試驗建立三元復合物的空間模型,化合物1的甲酯結構和化合物3的苯環上的羥基結構在空間位置上比較接近,設計連接子跨過空間連接兩個小分子配體,要保證設計的連接子不影響小分子配體在空間的位置和結構取向,設計如下圖的分子結構。
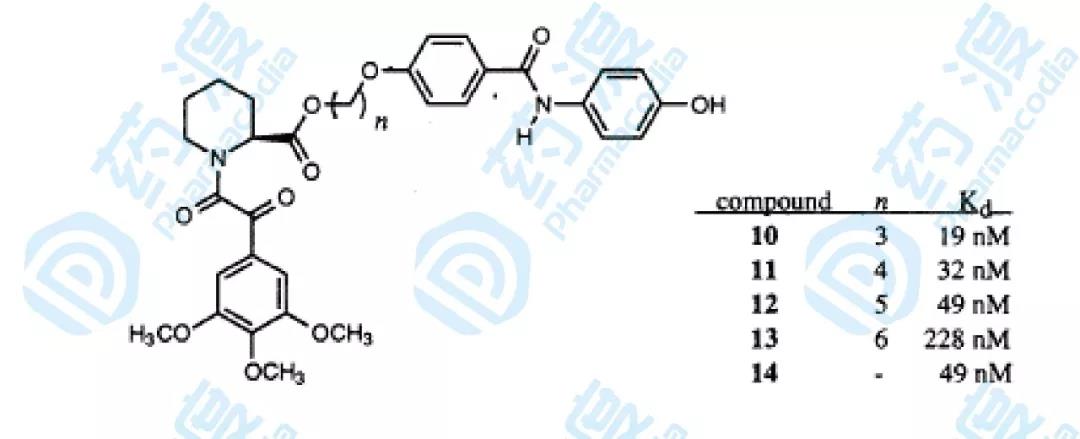
圖4.連接子連接后的化合物結構和生物活性圖
最終結果顯示化合物10具有最高的活性,化合物14的分子式如下圖,它采用了另一種連接方式,活性也達到了49nM。
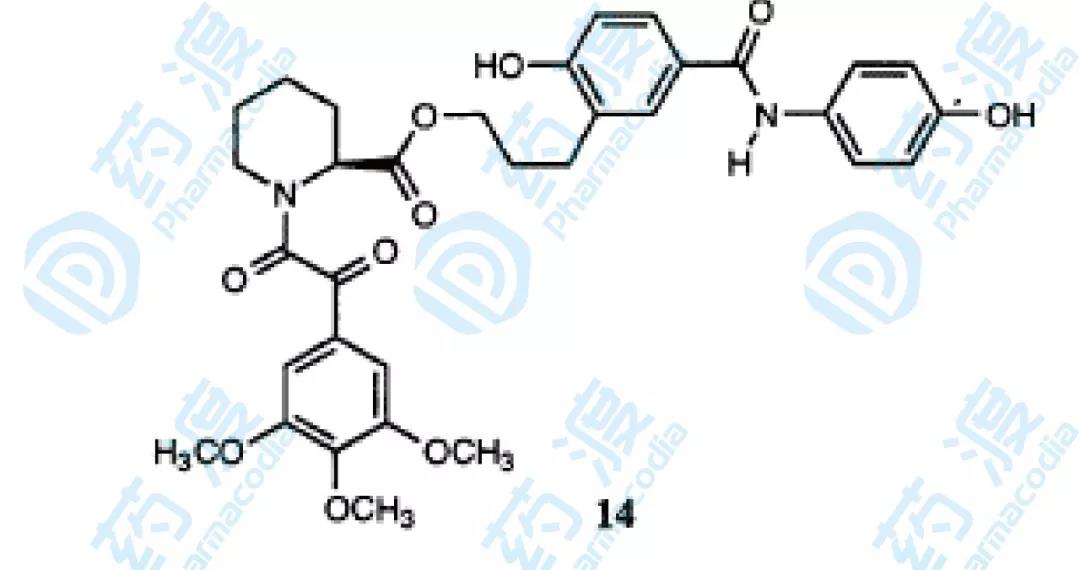
圖5.化合物14結構圖
為了觀察兩個小分子配體在連接之前和連接之后與結合蛋白的結合作用部位的變化,分別進行NOE研究,結果發現化合物1和化合物14的哌啶酸部分和三甲氧基苯基部分結合部位一樣,與蛋白形成疏水相互作用,另外化合物3與化合物14的結合位置相似,化合物3的苯甲酰環與蛋白中Gln53,IIe56,Arg57的相互作用在化合物14與蛋白的相互作用中沒看到,這又說明了盡管二者作用位點相似,但連接子的引入確實影響了化學位移的變化。
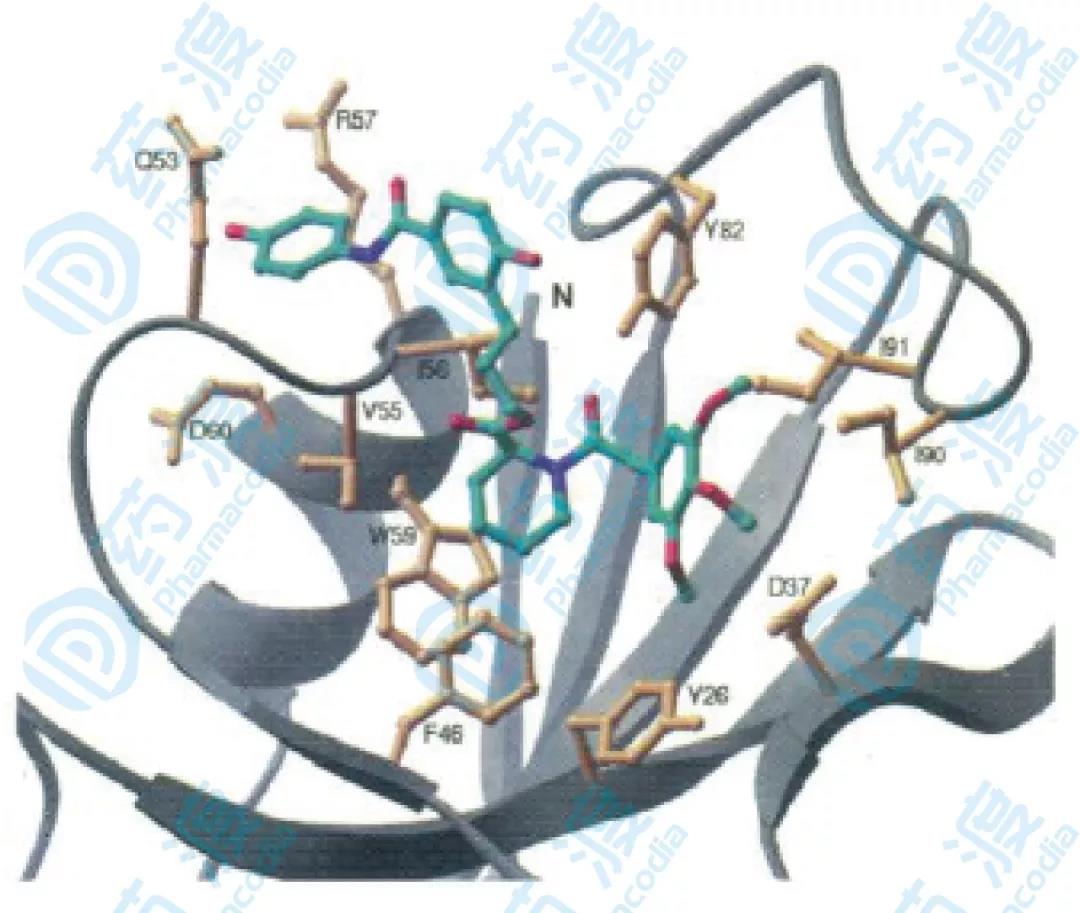
圖6.相互作用示意圖,黃色部分為結合蛋白和配體NOE效應的部分
從以上的實驗可以看出化合物1的Kd=2uM,化合物3的Kd=0.1mM,當利用連接子巧妙地連接兩個小分子配體后,得到的化合物活性都在nM級別。兩個配體可通過不同的連結子(linker)連接起來,這種連接可以從焓變和熵變對結合能的貢獻上得到理論支持[3],這使得先導化合物發現效率實現了一個質的飛越。
基質溶解素(MMP-3)非肽類抑制劑先導化合物的發現[4]
基質金屬蛋白酶(MMPs)是鋅依賴的家族內切蛋白酶,包括膠原酶,明膠酶和基質溶解素。該酶家族參與基質降解和組織重塑,并且與表達或失調時與關節炎和腫瘤轉移等病癥相關。盡管已經發現了基于底物特異性設計的有效的基于肽的抑制劑,但是這類化合物大多表現出差的生物利用度。已發現幾種非肽天然產物可抑制這類酶,如聚天冬氨酸和四環素衍生物。然而,這些化合物僅表現出中等的抑制活性。利用核磁共振技術S. W. Fesik等人成功的找到了對基質溶解素活性很高的先導化合物。
由于許多已知的MMP抑制劑含有異羥肟酸部分,用HSQC譜方法從化合物庫中篩選到乙酰羥胺(CH3CONHOH)對基質溶酶的親和力很弱,Kd=17mM,由于它的分子較小以及在緩沖液中的溶解度較大(大于500mM),未作任何優化選作第一配體。
在飽和量的乙酰羥胺存在下,用HSQC譜方法發現聯苯及其類似物可以結合基質溶酶Kd在mM范圍,經過近40余個聯苯化合物的結構-活性研究比較(如下圖),發現3'-氰甲基-4-羥基聯苯(26)與基質溶酶的親合力Kd達0.02mM。
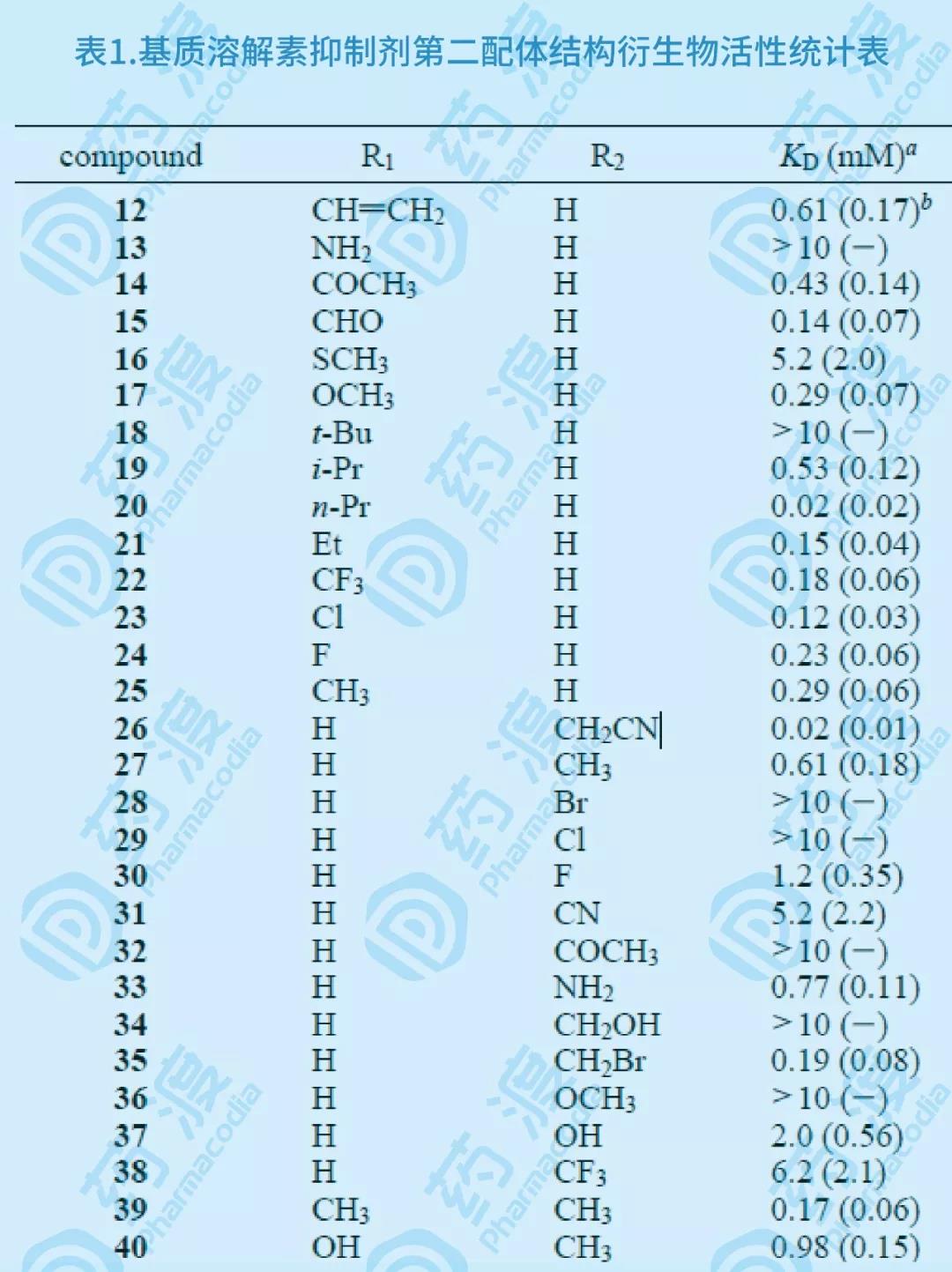
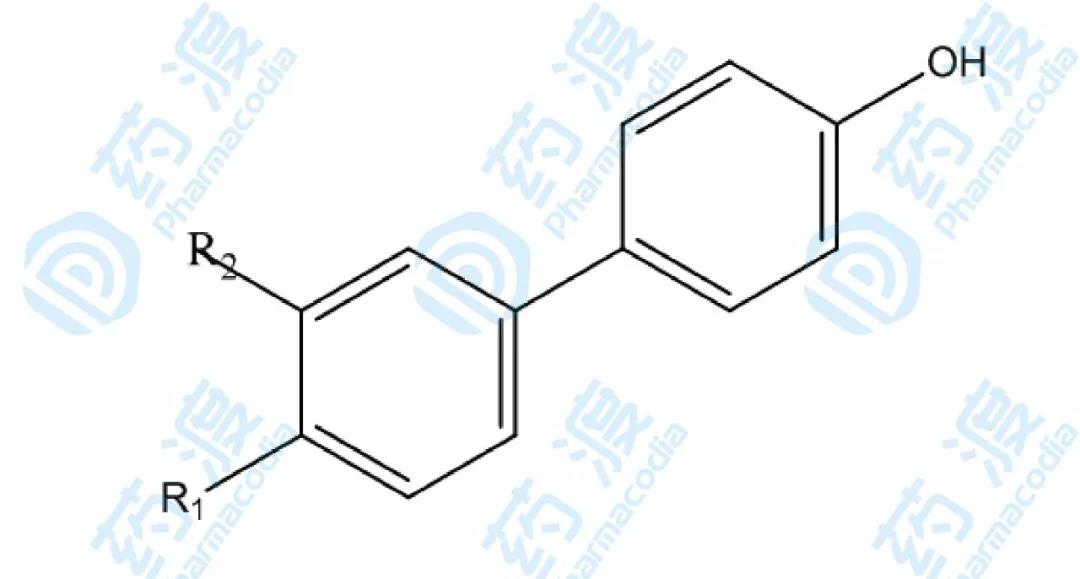
圖7.基質溶解素抑制劑第二配體結構衍生物示意圖
通過對乙酰羥胺、3'-氰甲基-4-羥基聯苯類似物以及基質溶酶的三元配合物的NMR研究,設計合成了11個化合物(45~55),生物活性實驗證明,與原有單體化合物相比,所有化合物的活性均有增強。對基質溶酶最具抑制活性的化合物50和53其IC50分別為25和15nM,活性增強近千倍。
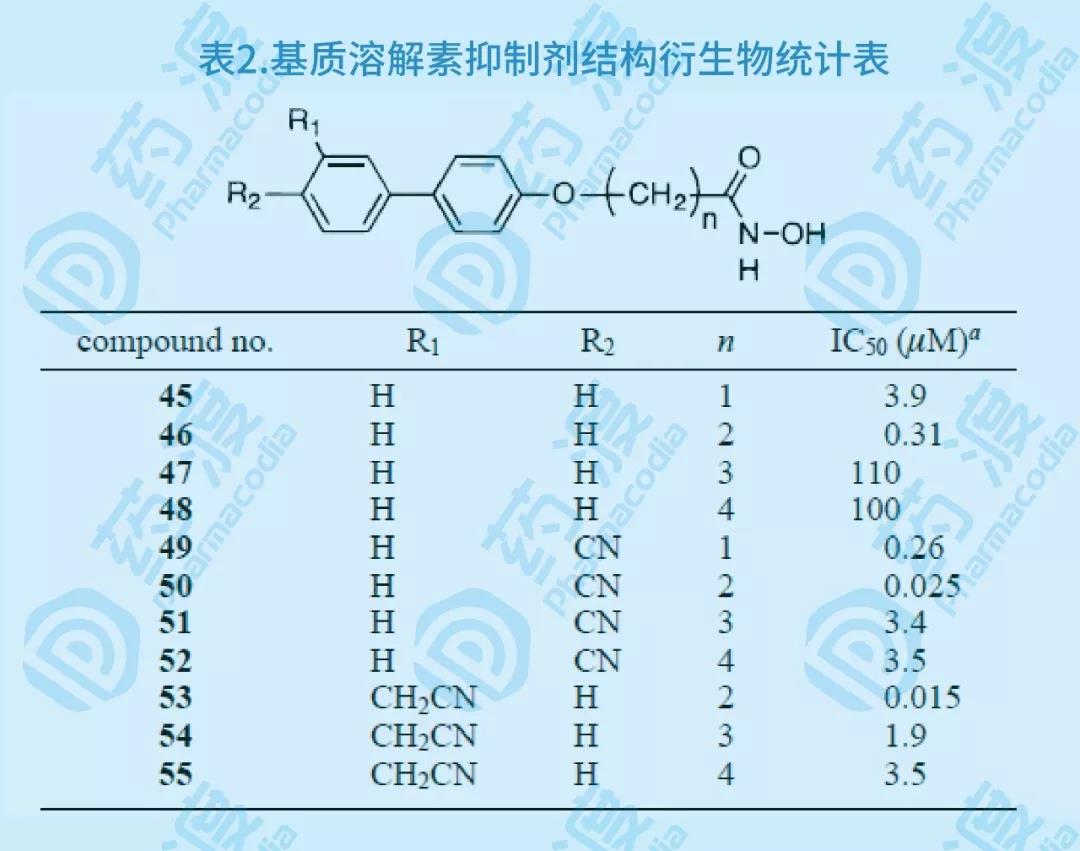
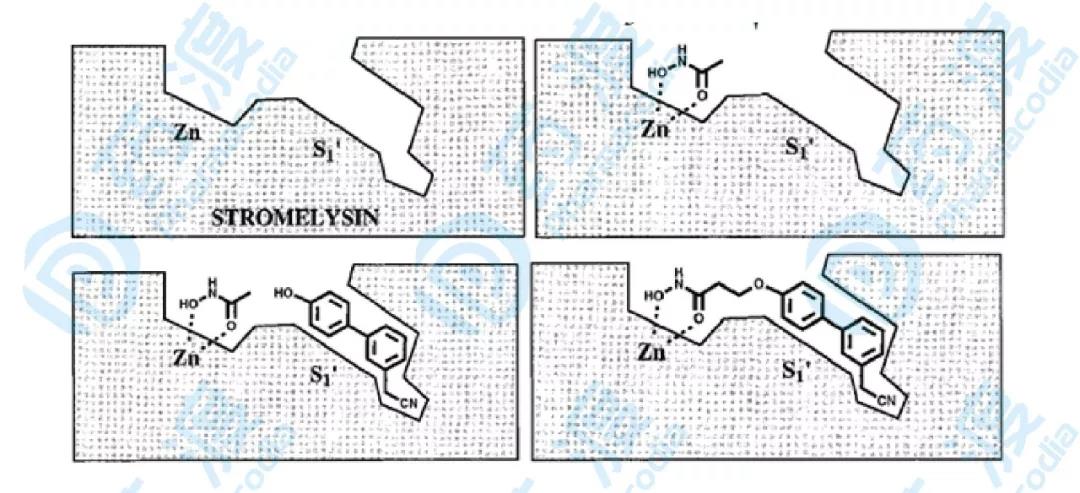
圖8.基質溶解素抑制劑藥物設計概括圖
“SAR by NMR”和組合化學的對比
“SAR by NMR”方法在概念上類似于組合化學,然而這兩種方法有本質的區別,在組合化學中發現配體需要制備測試大量的化合物,不幸的是,合成方案的選擇和生物測定往往既困難又費時,進而相對統一的條件需要限制有用的分子構建模塊及化合物的多樣性。在“SAR by NMR”方法中,配體已預選進行了優化,所以只需合成少數幾個化合物即可。另一方面“SAR by NMR”方法不同于組合化學,篩選小分子化合物的范圍僅僅受到水溶解度達mM濃度的限制,卻可以收集到多種多樣的化合物樣品[5]。
總結
以上介紹了核磁共振技術在新藥研發先導化合物發現中的運用,需要注意的是這種核磁共振技術需要大量15N同位素標記的結合蛋白,另外結合蛋白的分子量大都在40KD以下等一系列技術限制,不過目前已經開發出了兩種不需要15N標記蛋白的新方法-一維馳豫編輯和擴散編輯NMR方法[6],彌補了這種方法的不足。
SPA(閃爍分析法)存在著放射性污染的環保問題,熒光分析法存在著底物濃度效應,熒光猝滅效應,化合物自身熒光干擾等問題,高通量篩選過程中會出現假陽性、假陰性,自動化程度高可是先導化合物發現效率低,而計算機輔助藥物設計則存在著力場選擇簡單,計算過程繁瑣,與現實情況符合性存疑等問題。新藥研發的技術變革從未止步,相信隨著核磁共振技術的進一步發展,將繼續提高先導化合物的發現效率,使得整個新藥研發周期縮短。
參考文獻:
[1] 毛希安.現代核磁共振實用技術及應用[M].北京:科學技術文獻出版社,2000:251
[2] Discovering High-Affinity Ligands for Proteins:SAR by NMR[J]. Suzanne B. Shuker, Philip J.Hajduk, Robert P. Meadows,Stephen W. Fesik*. Science . 1996(274)
[3]Olejniczak E T, Hajduk P J, Marcotte P A, et al. J. Am. Chem. Soc., 1997, 119(25):5828.
[4] Hajduk PJ, Sheppard G, Nettesheim D G, et al. J. Am. Chem. Soc. 1997, 119(25):5818.
[5] 核磁共振技術在構效關系研究中的應用[J].化學通報,2001(1)
[6] Hajduk PJ, Olejniczak E T, Fesik S W. J. Am. Chem. Soc., 1997, 119(50):12257.
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:劉思慧)
右鍵點擊另存二維碼!
-
為你推薦












