輿情看點|研發以患者為中心 中藥創新藥步入收獲期 行業仍存難題待解
- 2023-06-21 16:22
- 作者:
- 來源:中國食品藥品網

編者按
近年來,國家藥監局全面落實《中共中央 國務院關于促進中醫藥傳承創新發展的意見》,遵循中醫藥發展規律,傳承精華、守正創新,持續推進中藥審評審批機制改革,建立完善符合中藥特點的注冊管理制度和技術評價體系,以臨床價值為導向,加快促進中藥新藥研制。2023年7月1日,《中藥注冊管理專門規定》將正式實施,進一步落實加快推進完善中醫藥理論、人用經驗和臨床試驗相結合(以下簡稱“三結合”)的中藥審評證據體系,體現中藥注冊管理的新理念和改革舉措,并加強了對中藥研制的指導。伴隨審評審批制度不斷深化,我國中藥創新藥產品迎來收獲期,據不完全統計,2021年中藥新藥和創新中藥獲批數量首次突破兩位數,2022年共有5款中藥創新藥獲批上市,部分產品與企業受到社會關注。然而,中藥創新藥的發展也存在一些待解難題,如醫療機構制劑轉化難、企業研發投入不高、中藥產品出海難等問題,需要進一步關注、研究。
審評審批制度不斷深化 中藥創新藥概念更加明確
2020年1月22日,國家藥監局發布的新版《藥品注冊管理辦法》(以下簡稱《辦法》)中規定,中藥注冊按照中藥創新藥、中藥改良型新藥、古代經典名方中藥復方制劑、同名同方藥等進行分類。為配合《辦法》實施,同年9月,國家藥監局發布《中藥注冊分類及申報資料要求》,其中明確,中藥創新藥指處方未在國家藥品標準、藥品注冊標準及國家中醫藥主管部門發布的《古代經典名方目錄》中收載,具有臨床價值,且未在境外上市的中藥新處方制劑。一般包含以下情形:1.1類“中藥復方制劑”,系指由多味飲片、提取物等在中醫藥理論指導下組方而成的制劑;1.2類“從單一植物、動物、礦物等物質中提取得到的提取物及其制劑”;1.3類“新藥材及其制劑”,即未被國家藥品標準、藥品注冊標準以及省、自治區、直轄市藥材標準收載的藥材及其制劑,以及具有上述標準藥材的原動、植物新的藥用部位及其制劑。
新注冊分類中的中藥創新藥類別不完全等同于2007版《藥品注冊管理辦法》中的第1、2、4、5、6.1類新藥。原中藥創新藥是指未在國家藥品標準、藥品注冊標準及國家中醫藥主管部門發布的《古代經典名方目錄》中收載,具有臨床價值,且未在境外上市的中藥新處方制劑類別。新的中藥創新藥分類以突出療效新為特色,重視臨床價值評估,注重滿足尚未滿足的臨床需求,并與以往僅要求在國內未上市的要求不同,應達到國內外均為新藥的要求。
此外,國家藥監局組織制定的《中藥注冊管理專門規定》(以下簡稱《規定》)將于2023年7月1日施行。《規定》進一步落實加快推進完善“三結合”的中藥審評證據體系,體現中藥注冊管理的新理念和改革舉措,并加強了對中藥研制的指導,具有較強的落地實操性,為中藥新藥研發拓展新思路,將極大地激發中藥新藥研發的新活力。
產品跑出加速度 2021年獲批中藥創新藥數量增長明顯
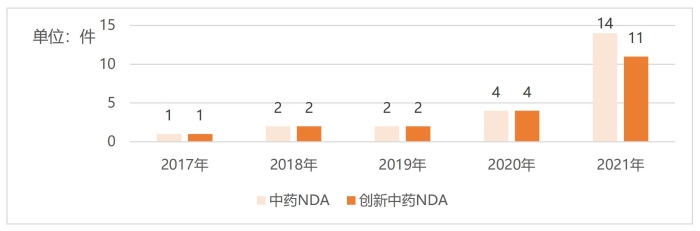
圖1 2017—2021年中藥NDA(新藥上市許可申請)、創新中藥NDA建議批準量
(數據來源:《2021年度藥品審評報告》)
伴隨相關政策文件出臺,制度不斷深化完善,中藥創新藥獲批數量交出滿意答卷。如圖1所示,2021年為近年來中藥新藥以及創新中藥上市數量最多的一年,其中創新中藥上市產品數量首次突破兩位數,達到11件。如表1所示,據不完全統計,2022年共有5款中藥創新藥獲批上市。除了已經獲批的中藥創新藥,截至2023年6月12日,還有21款中藥新藥在審評中,其中1類創新藥有11款,占比52.38%。
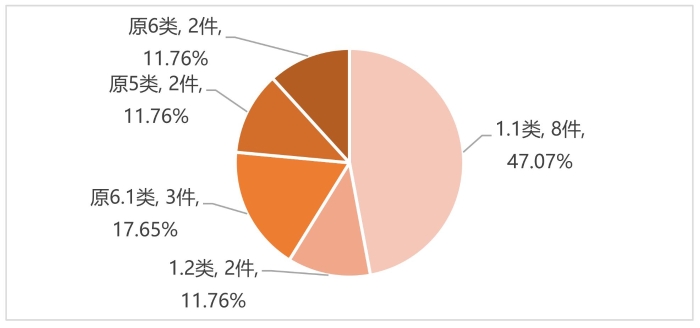
圖2 2020—2022年獲批中藥創新藥注冊分類情況
(數據來源:國家藥監局批準中藥新藥上市相關公告)
從注冊分類來看,如圖2所示,2020—2022年中藥創新藥中按照1.1類注冊上市的產品最多,共8件,占比47.07%。原6.1類產品共3件,占比17.65%。1.2類、原5類、原6類各有2件,分別占比11.76%。
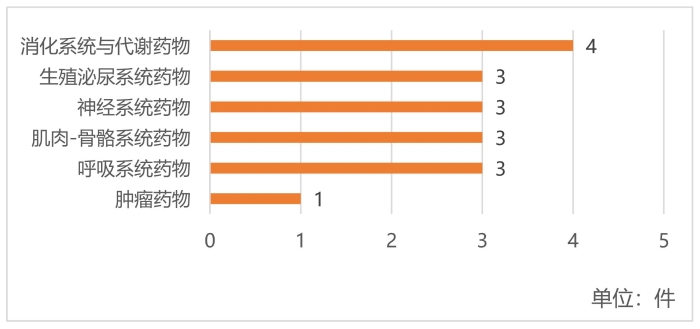
圖3 2020—2022年獲批中藥創新藥分類情況
(數據來源:藥融云數據庫)
如圖3所示,2020—2022年獲批的中藥創新藥中消化系統與代謝藥物數量最多,共有4件,其中糖尿病創新中藥2個,分別是芪蛭益腎膠囊和桑枝總生物堿片。此外,生殖泌尿系統藥物、神經系統藥物、肌肉-骨骼系統藥物、呼吸系統藥物各有3個。腫瘤藥物為2022年1月20日通過優先審評審批程序附條件批準上市的淫羊藿素軟膠囊。
中藥創新藥研發體現出以患者為中心、旨在解決臨床未滿足需求的趨勢。例如,我國糖尿病患者數量居世界之首。2020年,桑枝總生物堿片獲批上市,為近10年來首個抗糖尿病中藥創新藥。該中藥新藥上市,為2型糖尿病患者提供了一種新的治療選擇。在治療痛風領域,公開數據顯示,中國當前痛風患病人數估計已經超過1500萬人,同時抗痛風藥物在臨床上的需求高速增長,2021年國內首個治療痛風中藥創新藥虎貞清風膠囊獲批上市,該藥具有清熱利濕、化瘀利濁、滋補肝腎的功效,適用于治療輕中度急性痛風性關節炎中醫辨證屬濕熱蘊結證,將為患者提供新的治療選擇。
此外,還有幾項“首個”獲批的中藥創新藥受到社會關注。2021年11月10日,江蘇康緣藥業股份有限公司的銀翹清熱片獲批上市,這是自2020年7月1日新的中藥注冊分類實施以來,首個獲批上市的1.1類中藥,功能主治為辛涼解表、清熱解毒,適用于治療外感風熱型普通感冒,癥見發熱、咽痛、惡風、鼻塞、流涕、頭痛、全身酸痛、汗出、咳嗽、口干,舌紅脈數。其獲批上市為外感風熱型普通感冒患者提供了一種新的治療選擇。2022年12月29日,新疆維吾爾自治區首個國家1類中藥創新藥“參葛補腎膠囊”獲批上市。參葛補腎膠囊由新疆華春生物藥業股份有限公司與清華大學生命科學學院聯合自主研發,是治療輕中度抑郁癥的“十三五”國家重大新藥創制·科技重大專項項目。該藥由太子參、葛根和淫羊藿三味藥材提取精制的有效部位群復合而成,是治療輕中度抑郁癥的創新中藥。
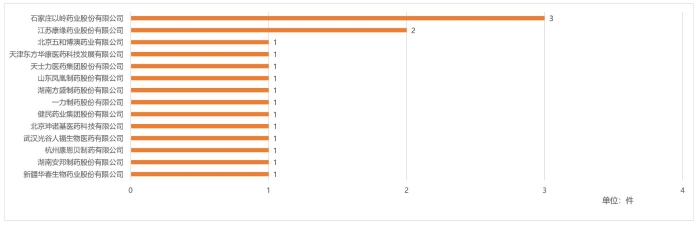
圖4 2020—2022年上市許可持有人獲批中藥創新藥數量
(數據來源:國家藥監局批準中藥新藥上市相關公告)
如圖4所示,從企業角度來看,近3年來獲批中藥創新藥數量最多的企業是石家莊以嶺藥業股份有限公司(以下簡稱以嶺藥業),共有3件。江蘇康緣藥業股份有限公司(以下簡稱康緣藥業)緊隨其后,共有2件。此外還有其他12家企業有1件藥品上市。
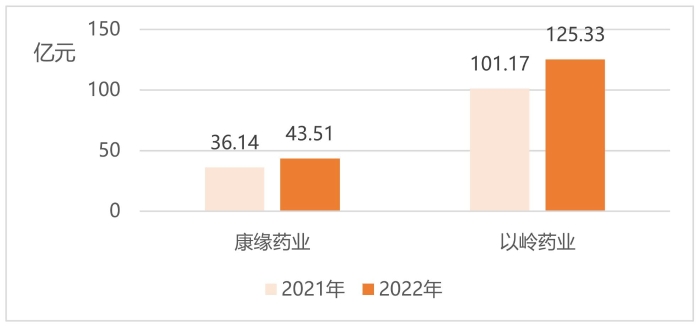
圖5 康緣藥業、以嶺藥業2021年、2022年營業收入
(數據來源:企業2022年年報)
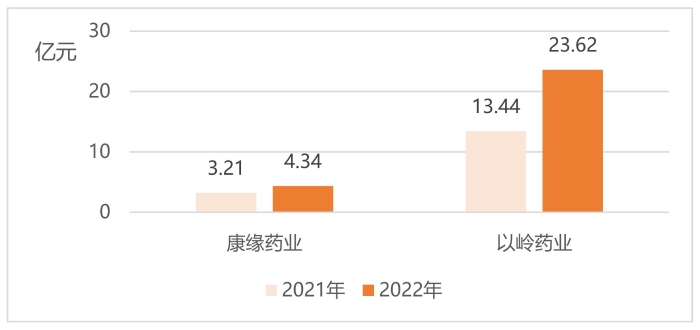
圖6 康緣藥業、以嶺藥業2021年、2022年歸母凈利潤
(數據來源:企業2022年年報)
中藥創新龍頭企業康緣藥業產品治療領域覆蓋呼吸、心腦、骨傷科、婦科等。2022年企業年報顯示,公司有46個藥品為中藥獨家品種,2022年共有2個中藥新藥上市,其中獲批的苓桂術甘顆粒為首個按古代經典名方目錄管理的中藥復方制劑,是深入發掘中醫藥寶庫精華、推進古代經典名方向現代藥品轉化的一次生動實踐,實現了中藥3.1類新藥從無到有的跨越。如圖5、圖6所示,2022年企業營業收入、歸母凈利潤均超兩位數增長,其中2022年實現營業收入43.51億元,同比上升19.25%。公司在穩定注射劑基礎上,大力發展非注射劑品種,非注射劑品種全年銷售收入達29億元,占總收入的66.65%,同比增長23.69%,產品結構進一步優化。歸母凈利潤方面,2022年公司凈利潤為4.34億元,同比增長35.20%。
以嶺藥業圍繞中藥品種研發,公司聚焦于心腦血管、呼吸、精神、內分泌、泌尿、消化等核心治療領域。現有研發管線覆蓋在研中藥創新藥品種40余個,覆蓋臨床12個系統疾病,圍繞已上市、研發不同階段、篩選階段進行研發陣列布局。2022年實現營業收入125.33億元,同比增長23.88%。歸母凈利潤23.62億元,同比增長75.75%。
在研發投入方面,以嶺藥業2022年投入金額8.95億元,同比增長6.87%,占營業收入的7.15%;康緣藥業2022年投入金額6.21億元,占營業收入比例的14.28%。兩家企業從研發投入的絕對金額和營業收入占比兩方面來看,均處于中藥行業頭部。
中藥創新藥“難”在哪兒? 醫療機構制劑轉化“難”
醫療機構中藥制劑具有較為豐富的人體使用經驗、較為規范的制劑配制工藝和質量控制標準,在新藥開發上具有獨特的優勢,是臨床經驗方與中藥新藥復方制劑之間的重要橋梁,但是醫療機構制劑的研發及使用過程中普遍存在臨床定位寬泛、無法證明臨床效果、臨床數據量少、數據不完整或缺失、臨床與成藥性脫節等問題,導致人用經驗的收集基礎相對薄弱、用于支持中藥新藥研發的臨床證據不足,成為現階段制約醫療機構制劑向中藥創新藥轉化的問題之一。南京中醫藥大學藥學院、江蘇省中藥藥效與安全性評價重點實驗室、江蘇省中醫藥防治腫瘤協同創新中心的韋忠紅、陸茵撰寫的《后疫情時代創新中藥新藥研發的策略與思考》一文中指出,醫療機構制劑的適應證寬泛、臨床定位不明確,日服生藥量較大、處方藥味數較多、缺少法定藥材標準或資源考慮不夠、組方重復率大等因素,雖不是影響成藥性的絕對原因,但會成為制約新藥研發的困難點。缺乏有效性的分子機制科學研究的基礎數據。其中,臨床評價的不規范是阻礙醫療機構制劑向新藥轉化的最主要因素。此外還有知識產權保護、利益瓶頸、缺少良好的合作研發平臺等問題。
中藥企業“重銷售、輕研發”
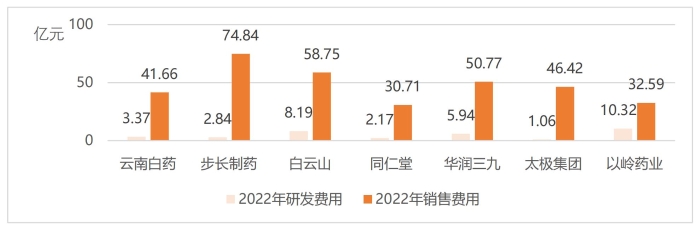
圖7 2022年部分上市醫藥企業研發和銷售費用情況
(數據來源:相關企業2022年年報)
產品銷售費用過高,一定程度上反映出公司的研發能力不足,產品不具備核心競爭力。從長期發展來看,企業需要提高自主創新能力,優化產品結構,依靠產品提升行業競爭力。在眾多中藥上市企業中,2022年研發費用超過5億元人民幣的僅有5家企業,分別是以嶺藥業、天士力、白云山、康緣藥業和華潤三九。中藥企業“重銷售、輕研發”的現象普遍,如圖7所示,部分中藥領域頭部企業研發費用不及銷售費用的10%,國內中藥企業關注終端市場,重視營銷渠道,但往往忽視了產品研發重要性。
百家號“北京商報”發布《研發強度低于行業平均水平,中藥革新仍待突破》稱,由于中藥新藥研發長期套用化藥標準,導致中藥新藥申請難度較大,中藥企業研發積極性不高。近年來,隨著中藥研發政策體系不斷完善,中藥企業研發投入持續加大,但研發強度(2022年前三季度為2.55%)仍低于醫藥行業平均水平(3.71%)。
微信公眾號“OMAHA聯盟”發布《我國中藥新藥研發現狀》稱,雖然中藥企的整體研發投入費用有所提升,但結合數據來看,2022年上半年也只有14家上市藥企研發投入比超5%,相較于多數投入比都在10%以上的化藥生藥藥企來說,研發投入仍有待提高。
中藥產品出海“難”
中醫藥在全球疫情防控中發揮了不可或缺的作用,此次的疫情向全球展現了中醫藥的特色與優勢,為中醫藥走出國門、走向世界提供了一個很好的契機。但是目前中成藥在美國市場仍未實現零的突破,與化學藥品相比,中藥的物質基礎及藥理機制更為復雜,有效性等方面的評估需要依托于嚴格的循證評價。但循證醫學證據困境恰恰與中醫藥理論體系不符也是中醫藥國際化的“瓶頸”所在。
微信公眾號“米內網”發表《中藥1類新藥井噴!中藥新藥研發的痛點與要點有哪些?》稱,中醫藥要想真正實現國際化,關鍵還是要以中醫臨床優勢病種為目標,研發符合國際注冊標準規范的藥品來破冰歐美等主流市場。按照FDA的《植物藥指南》,中成藥可以經進一步研究成為植物藥。雖然FDA先后出臺不少政策支持植物藥進入美國市場,但其在含多成分的植物藥的審評審批仍舊非常謹慎。FDA在對植物藥的審評審批上,非常注重質量,包括生產體系、種植體系等,臨床上先關注安全性再關注有效性。植物藥成分多且復雜、有效成分無明確定義、成分容易發生變化等,在質量、安全性、有效性等標準上難以明確,這給FDA的審評審批帶來很大的挑戰。如果在臨床開發過程中,植物藥的物質或產品發生變化,可能需要進行非臨床橋接研究。
微信公眾號“藥智網”發布《中藥創新藥Biotech,“倒”在黎明前》稱,為了能夠讓中醫藥獲得國際認可,中藥創新藥必須參照甚至沿用西醫西藥研發中的提取工藝、質量標準、藥理試驗、臨床試驗等實質性研究的內容和方法,用現代科技手段闡明中醫藥理論,證明產品臨床療效和安全性。
點評
從近年來中藥新藥及中藥創新藥在評以及獲批數量來看,目前中藥創新藥發展勢頭良好,已經步入收獲期。隨著《規定》的發布實施,將進一步落實加快推進完善“三結合”的中藥審評證據體系,體現中藥注冊管理的新理念和改革舉措,加強對中藥研制的指導,激發中藥創新的新活力。總體來看,中醫藥行業持續迎來政策利好,但中藥創新藥也同樣面臨一些挑戰和問題,未來相關部門和企業在深化行業改革、優化行業結構、規范行業健康發展的同時,也應傳承、創新并舉促進中醫藥高質量發展。(內容由中國健康傳媒集團輿情監測中心提供)
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:張可欣)
右鍵點擊另存二維碼!
-
相關閱讀
-
為你推薦
-

每周醫藥看點(9月22日—28日)
國家藥監局藥品和醫療器械審評檢查京津冀分中心、華中分中心、西南分中心掛牌成立;市場監管總局辦公廳、工業和信息化部辦公廳聯合發布通知,公開征集2025年度計量支撐產業新質生產力發展項目,... 2025-09-28 14:16 -
互聯網新聞信息服務許可證10120170033
網絡出版服務許可證(京)字082號
?京公網安備 11010802023089號 京ICP備17013160號-1
《中國醫藥報》社有限公司 中國食品藥品網版權所有










