輿情看點|2022年藥品優先審評公示情況統計
- 2023-02-14 15:42
- 作者:
- 來源:中國食品藥品網

自2020年新修訂《藥品注冊管理辦法》建立優先審評程序,《突破性治療藥物審評工作程序(試行)》《藥品附條件批準上市申請審評審批工作程序(試行)》《藥品上市許可優先審評審批工作程序(試行)》等文件發布以來,國家藥監局持續優化藥品上市注冊制度,加快具有明顯臨床價值的藥品上市速度。
本文根據藥審中心優先審評公示信息,對2022年被納入優先審評名單的藥品進行統計分析。總體來看,2022年共70件藥品(按受理號計)被藥審中心納入優先審評名單,較2021年的110件同比減少36%;覆蓋49個品種(按藥品名稱計),較2021年的67種同比減少27%,如圖1所示。
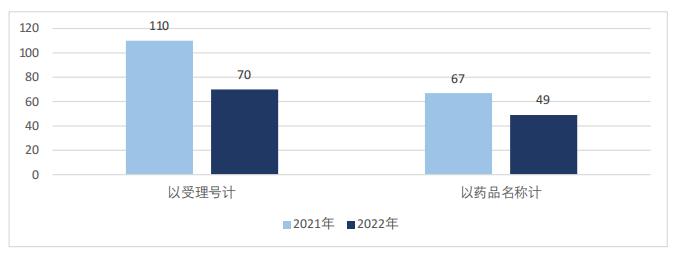
圖1 2021~2022年優先審評藥品數量
兒童用藥數量居首,3種藥品數量增長
按受理號統計,雖然2022年被納入優先審評名單的藥品總數相較于2021年有所減少,但是,突破性治療藥物、臨床急需藥品和疫苗產品數量有較大增長,兒童用藥數量排名升至首位。如圖2所示,2022年共23件符合兒童生理特征的新品種、劑型和規格兒童用藥品,是2022年占比最高的擬優先審評理由;共18件納入突破性治療藥物程序的藥品,相較于2021年的11件同比增長64%;共16件臨床急需的短缺藥品、防治重大傳染病和罕見病等疾病的創新藥和改良型新藥,相較于2021年的7件同比增長129%;疾病預防、控制急需的疫苗和創新疫苗共4件,相較于2021年的僅1件同比增長300%。而符合附條件批準的藥品和其他優先審評審批的情形則大幅降低。
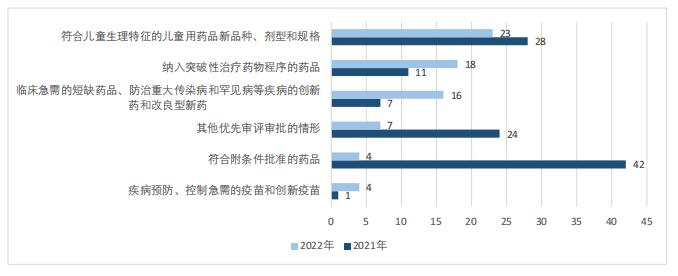
圖2 2021~2022年擬優先審評理由
中藥缺席優先審評,化藥占據大半江山
如圖3所示,2022年的優先審評名單中沒有出現中藥的身影,藥品類型以化學藥品為主,共53件,占比達到了76%;生物制品共17件,占比24%,其中,治療用生物制品共13件,占比18%,預防用生物制品共4件,占比6%。
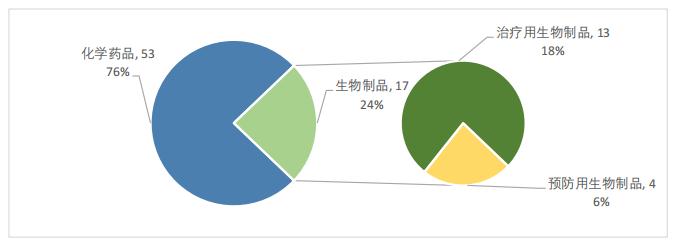
圖3 2022年優先審評藥品類型占比
創新藥總數占比增加
從注冊分類看,在化學藥品中,5.1類藥品最多,達到了22個,占比42%;3類藥品次之,共14個,占比26%;2類藥品共8個,其中,2.4類藥品共5個,占比9%,2.2類藥品1個,占比2%,2款藥品同時屬于2.2類和2.4類,占比4%;1類創新藥共6個,占比11%;4類藥品共3個,占比6%,如圖4所示。
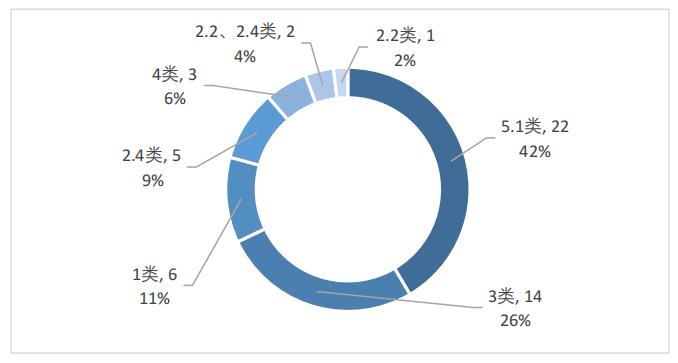
圖4 2022年優先審評化學藥品注冊分類
生物制品中,治療用生物制品以1類創新型生物制品為主,共6件,占比46%;2.2類和3.2類生物制品次之,各3件,分別占比23%;3.3類生物制品1件,占比8%,如圖5所示。
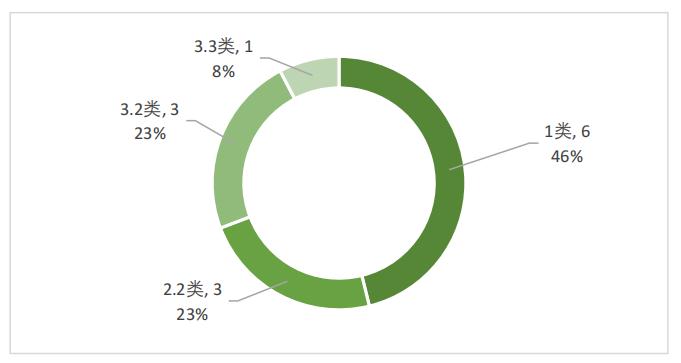
圖5 2022年優先審評治療用生物制品注冊分類
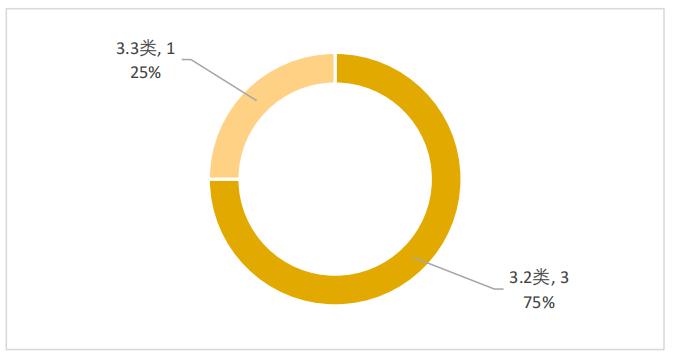
預防用生物制品包括3.2類疫苗3件和3.3類疫苗1件,分別占比75%和25%,如圖6所示。
圖6 2022年優先審評預防用生物制品注冊分類
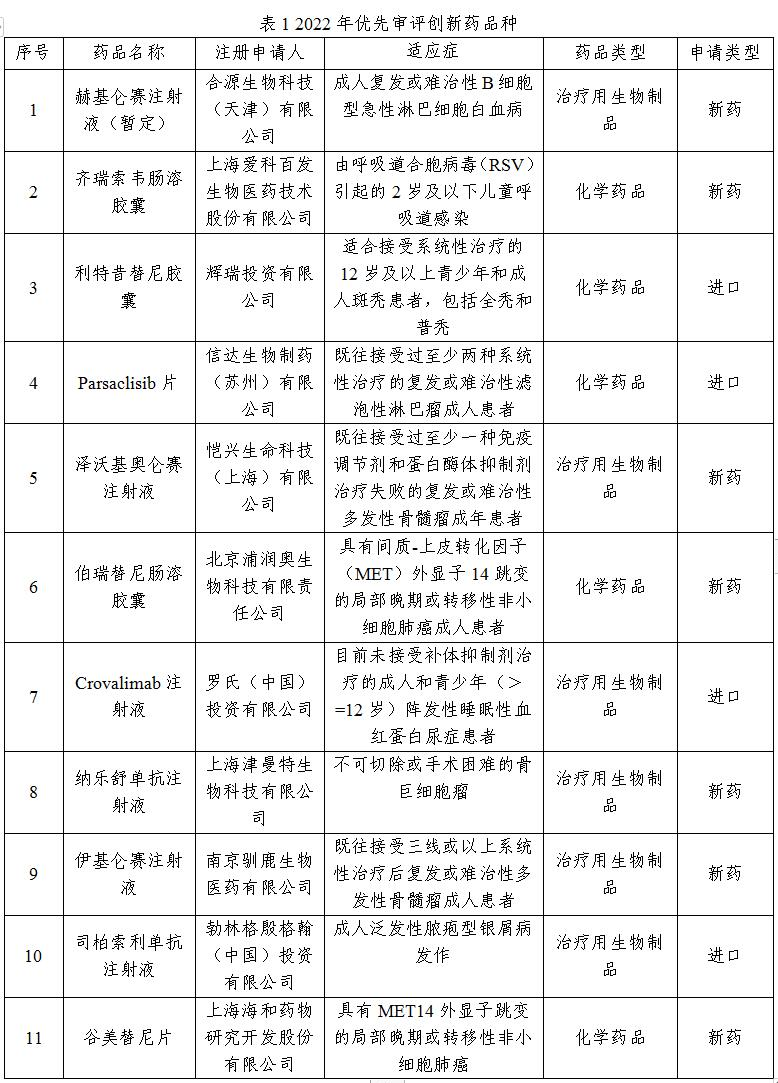
綜上所述,2022年共12件創新藥被納入優先審評名單,覆蓋11個品種,如表1所示。其中,包括5種化學藥品和6種治療用生物制品;4種創新藥為進口藥品,其他均來自本土藥企。
本土藥企包攬優先審評數量前三
2022年三家本土藥企被納入優先審評名單的藥品數量名列前茅。其中,深圳市康哲生物科技有限公司憑借甲氨蝶呤注射液(預充式)豐富的規格,以7件優先審評藥品的數量排名第一;祐兒醫藥科技(上海)有限公司在劑型和規格方面并重,憑借鹽酸哌甲酯口服緩釋干混懸劑和鹽酸哌甲酯緩釋咀嚼片共6件藥品排名第二;成都苑東生物制藥股份有限公司則憑借布洛芬注射液和甲硫酸新斯的明注射液共3件藥品排名第三。其余還有11家藥企有2件藥品被納入優先審評名單。
從2022年優先審評名單的情況看,在擬優先審評理由方面,國家藥監局制定的一系列政策有效地引導企業以臨床價值為導向研發藥品,尤其促進了兒童用藥的持續創新和發展;在藥品類型方面,化學藥品仍然是優先審評的主力軍,中藥則在名單中一藥難求,仍需政策鼓勵;在藥品創新方面,本土藥企創新能力不斷提升,逐步在政策引導下實現創新轉型。(內容由中國健康傳媒集團輿情監測中心提供)
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:張可欣)
右鍵點擊另存二維碼!
-
為你推薦
-

-

互聯網新聞信息服務許可證10120170033
網絡出版服務許可證(京)字082號
?京公網安備 11010802023089號 京ICP備17013160號-1
《中國醫藥報》社有限公司 中國食品藥品網版權所有