生物醫藥企業應對美國貿易管制之道
- 2021-12-29 13:59
- 作者:劉新宇 張運帷
- 來源:中國食品藥品網
2021年12月15日,美國彭博社稱,美國方面希望將20家包含醫藥生物企業在內的中國實體列入實體清單(Entity list),15日當天,A股尾盤多支創新醫藥股大跌,跌幅超過10%。
12月15日晚間,美國總統拜登簽發了一項針對參與全球非法藥物貿易的外國主體實施制裁的行政命令,并將五個實體(一名個人和四家公司)列入美國海外資產控制辦公室(OFAC)旗下的特別指定國民清單(SDN清單),其中包含兩家中國公司,被列入原因系芬太尼藥物濫用和非法藥物交易。
盡管本次制裁對象系參與國際非法藥物貿易相關個人及公司,與CXO上市公司及生物醫藥創新公司并不相關,但生物醫療領域一直以來均系美國方面重點關注的領域,該領域企業的貿易管制風險不容忽視。
生物醫療領域的美國貿易管制大事記
美國為保持其技術、科學等方面的領先地位,對中國生物醫藥領域的打壓由來已久。近年來,其采取包括限制投資、加征301關稅、將主要頭部企業列入各類管制清單以及加強技術出口管制等一系列措施,對相關領域的中國企業予以限制與制裁。
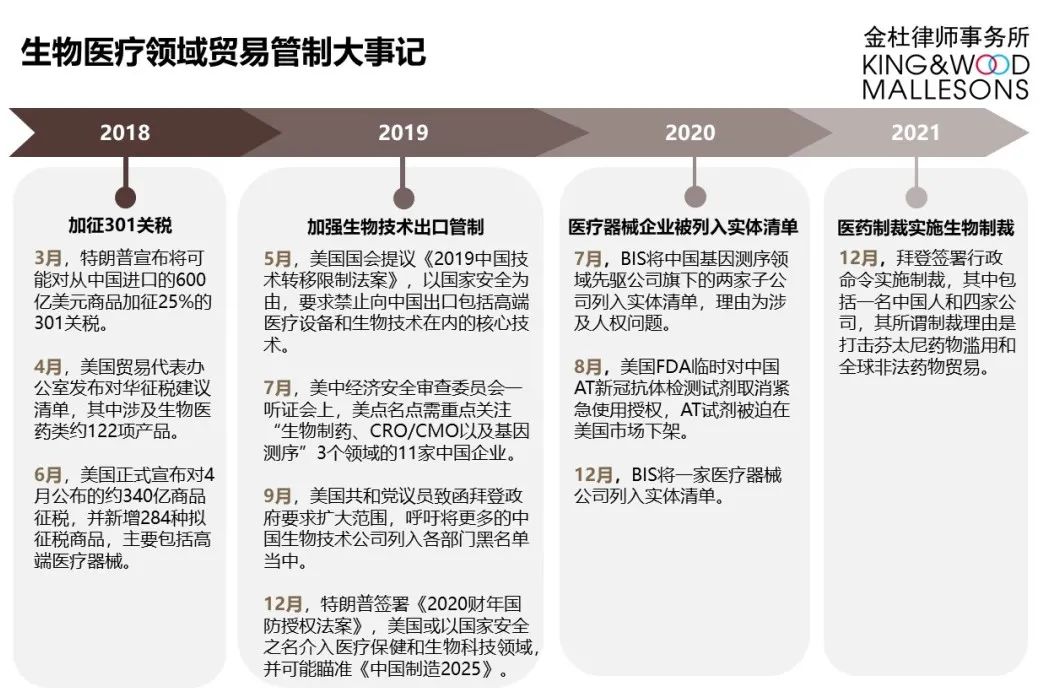
美國對生物醫藥領域企業的具體限制措施
生物技術
近年,中國成為生物技術研發和產業化的重要市場和利潤中心。對此,美國以諸如將新興技術與基礎技術納入到美國受控物項(含技術)的范疇等手段,不斷加強對技術出口的限制。
2020年10月,美國商務部工業和安全局(BIS)對外發布了針對六大類新興技術的管控措施,該項管控舉措,在《出口管制改革法案》(ECRA)公開征求意見近兩年后才予以推出,其延遲推出的原因不排除針對新興技術本身的定義、范圍等立法難點的反復糾結,亦不排除BIS為確保該類管控舉措不僅可在美國落地,同時也可以被其盟友所采用的反復考量。舉例而言,BIS即主管著其作為重要成員的多邊組織澳大利亞集團(AG)所認定的某些兩用微生物、毒素、生物設備和相關技術,從而使該等物項、技術在出口時,需要向美國商務部申請相關許可證。但在實踐中,該等許可證申請很難獲得批準。如此一來,美國便有效限制了生物技術類戰略性物項流向境外。同時,將管控舉措推向多邊組織,無疑將進一步擴大管控的范圍,從而使中國企業不僅從美國獲取相關物項的難度加大,從其他國家獲取此類物項很可能也將面臨困境。
2021年10月5日,BIS在《聯邦公報》上發布了一項最終規定,對可能用于制造生物武器的軟件和技術實施新的控制。對此,BIS通過修改商業管制清單(CCL)增加新的出口管制分類號(ECCN)2D352的方式來實施控制。美國針對某些生物設備軟件(即2D352)的新出口限制將對實驗室、生命科學公司、大學和研究機構產生重大影響,并可能導致在外國投資方面的重大障礙。2021年12月16日,BIS再次假借維護美國國家安全和外界利益的事由,將中國某軍事醫學科學院及其下屬研究機構列入實體清單。
據BIS官方統計數據顯示,美國先進生物技術出口至中國的比重在2019至2020年期間,環比大幅下跌19%,具體圖示如下:
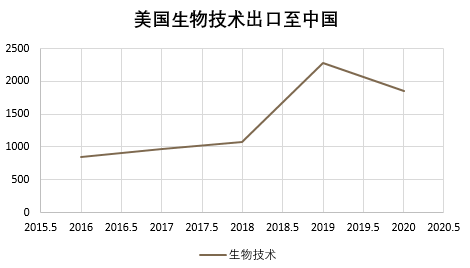
(單位:百萬美元)
由此可見,美國單邊管控生物技術的出口,并繼續加強對新興技術和基礎技術的管控,同時推動多邊機制共同加強監管,除了物項管制以外,BIS也繼續落實其出口管制重要工具之實體清單,通過將中國生物技術相關企業加入實體清單的方式進一步對其予以打壓。而面對生物醫藥行業普遍存在的并購模式,美國政府也開啟了針對新興技術的國家安全審查,通過BIS/CFIUS等各不同職能維度并在各項業務開展模式中設置審批審查機制,防止美國先進技術流入中國,以此阻礙正常的商業運作。
生物制藥
中國生物制藥產業起步較晚,研發基礎較弱,對美國的依賴程度較高,例如當前在上游生物專用藥原材料與研發設備供應兩方面,仍然嚴重依賴從美國進口。
對此,美國仍在關鍵物項上施加出口管制等舉措。生物制藥方面,CCL規定的受控物項包含:ECCN 1C351(人類和動物的病原體及毒素)、1C353(遺傳因子和轉基因生物)、1C354(植物病原體)和1C991(疫苗、免疫毒素等)。同前述生物技術領域一樣,上述不同ECCN管控項下的生物物項,也有著不同的管控級別和許可要求,并且多數都由于生化武器的管控原因(CB1/CB2/CB3),導致該等物項從美國出口至其他國家,需要獲得BIS頒發的出口許可證,而上述生物物項基于同樣生化武器管控原因,如果出口目的地是中國,那么目前的政策一律要求申請出口許可證。
其次,多數生物制藥企業均擁有廣泛的國內與國際業務及市場,客戶、分銷商及最終用戶遍布全世界,而這些特點也使得生物制藥行業的參與者可能面臨愈發嚴格的管制與制裁方面的監管挑戰,并成為美國執法的目標。
醫療器械設備(含研發器械)
生物制藥過程中涉及的研發、檢驗、制造三類醫療器械設備同樣嚴重依賴進口產品。盡管其中有些物項已實現國產化或國產進口兼有,但由于在質量功能上存在差距,目前仍存在國外壟斷“卡脖子”的風險。而這類醫療器械設備,同樣在美國CCL的管控之下,包括閥、泵、反應器、攪拌器、發酵罐及各式實驗設備等,通常歸于2B350和2B352項下,出口至中國需要申請出口許可證。
從過往10年執法案例實踐來看,醫療器械領域企業受處罰的比例相對較高,2016年引人矚目的某大型制藥企業向美禁運國家伊朗等銷售大量外科手術設備及藥品,受到940萬美元處罰;2017年,美國某超聲設備供應商因涉伊朗交易,向OFAC支付50萬美元處罰等。由過往執法及處罰案例可見,美國政府對醫療器械領域供應鏈活動的關注度極高。
生物醫藥領域企業面臨的困境
可以看出,在無法擺脫技術受限、原料受控、先進設備受限的產業大背景下,生物醫藥領域的中國企業主要面臨如下具體困境:
關鍵物項“卡脖子”問題
從物項層面而言,生物醫藥領域相關企業就涉美特定物項獲取難度將進一步加大。雖然目前理論上可以通過出口商申請出口許可的方式獲取部分涉美物項,但實踐中不少戰略性物項許可申請實則為特定拒絕。如特定必要物項后續無法采購,勢必將造成國內企業供應鏈的中斷甚至是斷裂,進而導致隨后一系列如生產停滯、合同違約等重大風險。就長期而言,即使目前可以通過許可獲取的物項,隨著政策形勢的變化,未來也可能導致出現同類物項無法采購的現實性風險。
進一步說,如相關限制后續升級導致相關企業被美國列入實體清單,那么對清單企業而言,受限的則不僅僅是這類特定的戰略性物項,而是在整個涉美依賴方面的供應鏈整體都可能受到更加嚴重的打擊,即無法采購更廣泛的涉美物項。與此同時,其他國家和地區在研發、制造等過程中亦可能涉及美國技術、物項等,此時其欲將產品銷售給清單企業,也同樣受到美國出口管制相關規定的限制。
此外,據悉美國正推進向瓦森納安排機制提出建議,將相關技術納入多邊管制,倘若瓦森納安排機制接受了此類建議,可以預見各成員國將收緊相關技術的出口管制政策,進而導致相關企業未來的跨境技術研發安排和布局受到更為嚴重的不利影響,中國企業從其他國家和地區尋找“替代產品”的難度將進一步增大。
間接獲取關鍵物項或技術受阻
鑒于上述供應鏈斷裂風險,有不少中國生物醫藥企業在難以直接獲取先進物項或技術的情況下,考慮通過采取并購境外企業的方式,間接獲取相關物項、技術,同時擴大客戶群體,助推企業進入特定市場領域。
然而,自2018年美國《外國投資風險評估現代化法案》(FIRRMA)推出以來,FIRRMA擴大了美國外國投資委員會(CFIUS)的審查權限和“關鍵技術”范圍。可以預見,中國企業若想通過采取并購境外企業的方式獲取所需技術、物項,也將面臨美國貿易和投資方面的聯動阻礙。此外,根據2019年生效的《歐盟外資審查條例》,中國企業對歐盟企業的投資并購,也將受到愈發嚴格的外資審查。由此可見,中國生物醫藥企業在海外投資并購阻力明顯增加。
人才交流受限
最近幾年,中美之間的人才流動與技術交流面臨著更多挑戰。在新冠肺炎疫情尚未暴發時,美國就曾以多種理由限制中美之間生物科技方面的技術、人才交流。2019年4月,美國安德森癌癥中心解雇了3名華人生物科學家,其理由是3人可能“嚴重”違反了保密原則,向中國政府透露了重要研究成果和數據。同年5月,美國埃默里大學辭退了華裔人類遺傳學家教授夫婦,其理由是該對夫婦沒有充分披露來自中國的研究經費,以及他們在中國研究機構和大學的工作內容。
在疫情暴發以及后疫情時代,人才流動本就受疫情防控等因素影響而受到很大限制,加上各國更加注重保護本國生物科技成果,若再受到限制清單等限制或制裁,中美之間、中國與其他國家之間在生物醫藥領域的人才流動與技術交流,只會“雪上加霜”,面臨更多阻力。
經濟制裁風險
疫情下,生物醫藥企業的產品進出口更加頻繁。近期,針對委內瑞拉、伊朗、朝鮮等特定制裁國家,美國OFAC在經濟制裁方面規定了特定的許可豁免政策,即美國和非美國人員可根據美國制裁法律和法規的現有豁免、例外和授權,向特定受美國制裁的國家或地區提供人道主義物品,包括藥品和醫療器械。與此同時,對于此類項目中可能對抗擊疫情有幫助的物項,例如氧氣發生器、全罩式口罩呼吸器、某些診斷醫學成像設備和去污設備等,美國OFAC考慮并加快對這些許可請求的審查。
但是需注意,若是出口的生物醫藥產品被認定為不屬于豁免范疇的,如有發展為生化武器的風險,則可能會受到制裁。實務中,醫藥企業在從事進出口業務的過程中時有提供超出許可的產品或服務,從而觸碰美國出口管制與經濟制裁紅線的案例。此時,除了受到罰款以外,還可能導致其被列入SDN清單,從而出現對外交易全面受阻的情況。
美國貿易管制環境下生物醫藥領域企業的應對措施
全面的風險評估與動態預警
相關的中國生物醫藥企業應對美國出口管制及經濟制裁相關法律法規的重點內容進行學習和解讀,并在防患于未然的大前提下,提前委托專業人士并利用專業工具,結合企業自身經營狀況進行風險評估,例如排查供應鏈安全,并對相關信息等進行持續、完善的搜集和動態追蹤,以便提前預警。
就供應鏈安全而言,企業應提早熟悉生物醫藥產業所涉及的擬引進主要物項的受控情況,對現有的業務模式及所涉及的商品、技術、軟件等進行全面梳理,并有針對性地減弱對中游研發過程中涉美管控物項的依賴,同時,針對依賴度較高的涉美關鍵物項,在可能的情況下有計劃地適當增加部分物項的采購數量,提高庫存儲備底線要求,同時積極尋找并探討供應鏈替代方案,以分散供應鏈的國別和區域風險。
此外,相關企業除需關注受限商品、受限技術,以及其最終用途、最終用戶等常見注意事項之外,還需對國家和地區、人權等特定領域的話題保持敏感,通過尋求專業機構幫助,在自身風險防控上做好監管與審查,規避“可預見”風險。
藥品許可交易合同的梳理審查
越來越多的中國藥企廣泛參與藥品許可交易。交易時,相關企業通常作為被許可方引進境外上市藥品,據此享有在中國境內和其他區域的對該等藥品的研發、生產和商業化權利。此類交易的許可藥品通常來自美國、歐盟或其他設有嚴格出口管制制度的國家或地區。藥品出口國的出口管制政策變化可能導致藥品技術無法出口至中國,導致交易的合同目的落空,相關企業可能在支付了高額的許可費之后卻無法取得許可藥品。
建議中國藥企梳理已經簽署的藥品許可交易合同,審查是否已訂立出口管制、經濟制裁相關條款,約定如果許可藥品技術因出口國法規、政策變化或難以取得批準而導致無法將其出口至中國,則境外許可方應當退還許可費并補償被許可方的相關損失。(作者單位:金杜律師事務所)
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:劉思慧)
右鍵點擊另存二維碼!
-
相關閱讀
-
為你推薦
-
-

生物醫藥企業應對美國貿易管制之道
實務中,醫藥企業在從事進出口業務的過程中時有提供超出許可的產品或服務,從而觸碰美國出口管制與經濟制裁紅線的案例。此時,除了受到罰款以外,還可能導致其被列入SDN清單 2021-12-29 13:59
互聯網新聞信息服務許可證10120170033
網絡出版服務許可證(京)字082號
?京公網安備 11010802023089號 京ICP備17013160號-1
《中國醫藥報》社有限公司 中國食品藥品網版權所有









