數據|國內企業品種瘦身 跨國藥企產品調整 從藥品注冊證書注銷看產業變化
- 2021-06-07 11:12
- 作者:胡芳 辛悅然
- 來源:中國食品藥品網
中國食品藥品網訊(記者胡芳 實習記者辛悅然) 5月24日,國家藥監局官網發布《關于注銷醋酸甲地孕酮分散片等283個藥品注冊證書的公告(2021年第70號)》(以下簡稱《公告》)。《公告》顯示,依據企業申請,國家藥監局決定注銷醋酸甲地孕酮分散片等283個藥品注冊證書。記者梳理發現,283個品種除了同質化嚴重的老普藥,也包含部分跨國藥企的明星產品。
不難看出,隨著仿制藥一致性評價推進、藥審改革持續深入以及國家藥品集中帶量采購和使用常態化,國內企業對藥品注冊證書的認識更為理性,大量無意義的普藥將隨著藥品注冊證注銷而消失;與此同時,跨國藥企在華經營策略也悄然發生改變,更傾向于將新上市產品以及專利藥引入中國,原研藥則將陸續退出,以避開與中國仿制藥的直面競爭。我國醫藥市場將進一步去贅肉、強筋骨,實現良性發展。
大量藥品注冊證“依申請注銷”
根據《公告》,上述283個藥品注冊證書涉及28家企業。除了24家國內企業外,還有4家是跨國藥企。
其中注銷藥品注冊證書數量排名前十(含并列,共十二家)的企業分別為江蘇晨牌藥業集團股份有限公司、江蘇大紅鷹恒順藥業有限公司、海南全星制藥有限公司、江蘇正大豐海制藥有限公司、金陵藥業股份有限公司南京金陵制藥廠、海南賽立克藥業有限公司、南通久和藥業有限公司、江蘇金塔藥業有限公司、江蘇瑞年前進制藥有限公司、海南雙成藥業股份有限公司、江蘇亞邦愛普森藥業有限公司、江蘇亞邦強生藥業有限公司(見表1)。
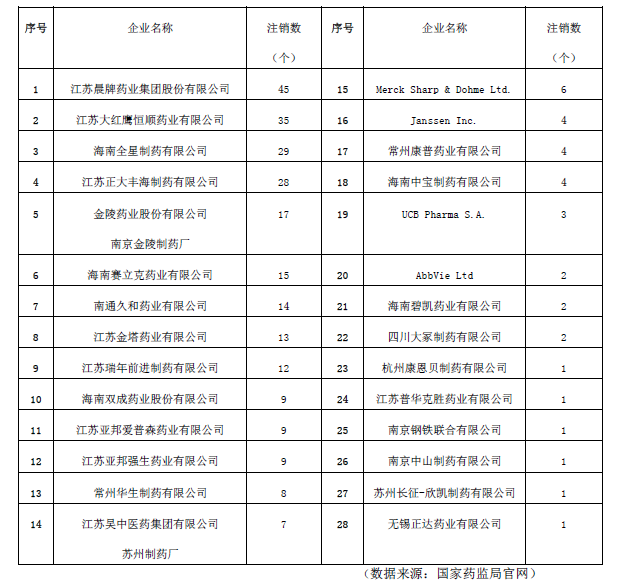
表1 企業注銷藥品注冊證書情況統計表。
這也是自2020年9月以來,國家藥監局第五次集中公告藥品注冊證書注銷信息:
2020年9月8日,國家藥監局公告注銷注射用前列地爾等78個藥品注冊證書;2020年12月9日,國家藥監局公告注銷對乙酰氨基酚片等115個藥品注冊證書;2020年12月29日,國家藥監局公告注銷諾氟沙星膠囊等207個藥品注冊證書;2021年3月1日,國家藥監局公告注銷菠蘿蛋白酶腸溶片等226個藥品注冊證書;2021年5月24日,國家藥監局公告注銷醋酸甲地孕酮分散片等283個藥品注冊證書。在這些被公告撤銷藥品注冊證的,絕大多數為“依申請注銷”,即企業主動申請注銷。
相關人士表示,2020年是藥品再注冊的“大年”。根據《藥品注冊管理辦法》,持有人應當在藥品注冊證書有效期屆滿前六個月申請再注冊。“但一個注冊證再注冊的費用是近2萬元,企業手上如果有幾百個注冊證,再注冊費用就是幾百萬元。那么企業在進行再注冊時,會結合企業發展,權衡成本與收益,主動放棄部分產品,向省級藥監局申請注銷注冊證,省級藥監局統一報給國家藥監局,國家藥監局匯總后集中公布。”
國內企業清理無效文號
藥品的注冊證書是藥品的“準生證”。對于企業主動注銷藥品注冊證,北京百思力營銷策劃有限公司創始人王恒認為,最直接原因就是這些藥品對企業來說意義不大,有的是企業一直未生產(即業內所稱“僵尸文號”),有的即使生產但不掙錢甚至是虧損品種,“在某種程度上實際是國內企業的一種‘斷舍離’。”
從通用名來看,在《公告》注銷的藥品中,葡萄糖注射液、葡萄糖氯化鈉注射液位居注銷榜榜首,分別為12個、9個;此外乙酰螺旋霉素片、磷酸西格列汀片、安乃近片、甲硝唑氯化鈉注射液、硫酸小諾霉素注射液、氯霉素片注銷數均在5個及以上。
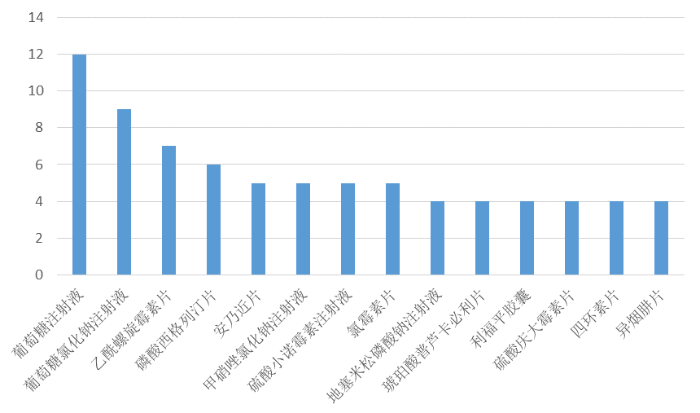
圖1 申請注銷藥品許可證數量前十四(含并列)的藥品名稱。(數據來源:國家藥監局官網)
查詢國家藥監局官網即可發現,此次《公告》注銷的,絕大多數都是過度重復藥品,如葡萄糖注射液、葡萄糖氯化鈉注射液的現有注冊證總數達3300個;乙酰螺旋霉素片的現有注冊證數量為482個;安乃近片的現有注冊證數量為844個;甲硝唑氯化鈉注射液的現有注冊證數量為228個;氯霉素片的現有注冊證數量為354個;硫酸小諾霉素注射液現有注冊證數量為138個……
品種高度同質化不僅意味著企業很難在市場中占到優勢,同時意味著仿制藥一致性評價壓力巨大。
根據國家藥監局相關公告,化學藥品新注冊分類實施前批準上市的含基本藥物品種在內的仿制藥,自首家品種通過一致性評價后,其他藥品生產企業的相同品種原則上應在3年內完成一致性評價。而完成一個產品的仿制藥一致性評價,大概需要500~1000萬元。當企業沒有能力完成一致性評價時,所能做的也只能是主動申請注銷該品種的注冊證。
一位業內人士也指出,多年以前,藥品注冊證私下交易屢禁不絕。但隨著國家鼓勵創新以及醫保政策調整,尤其是在MAH制度下,藥品上市許可轉讓呈現出新的特點,即充分考量其臨床價值及稀缺性。這也使得企業手中大量普藥的注冊證書失去轉讓(買賣)的意義。
跨國藥企調整經營策略
值得注意的是,此次《公告》中出現了跨國藥企的明星產品,如艾伯維的奧比帕利片、達塞布韋鈉片,默沙東的磷酸西格列汀片、優時比的左乙拉西坦片,楊森公司的琥珀酸普蘆卡必利片等。
但這并不是跨國藥企產品首次出現在國家藥監局藥品注銷公告當中。據統計,從2020年9月至今,共有16家跨國藥企主動注銷了45個藥品注冊證書(見表2)。有業內人士認為,跨國藥企主動注銷藥品注冊證,傳遞出其在華經營策略的轉變。
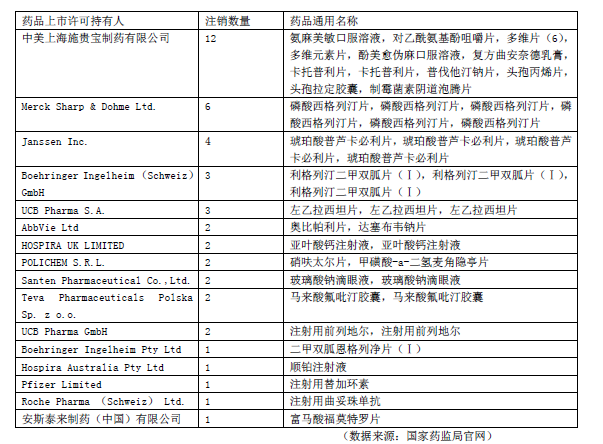
表2 跨國藥企2020年9月~2021年5月注銷藥品情況。
資料顯示,奧比帕利片聯合達塞布韋鈉片治療方案于2017年9月20日首次在中國獲批,2018年1月上市,用于治療無肝硬化或伴代償期肝硬化的基因1型慢性丙肝。記者注意到,奧比帕利片、達塞布韋鈉片目前國內尚未有仿制藥上市,意即艾伯維注銷產品注冊證后,這兩個產品就此退出中國市場。對此,艾伯維相關人士表示,公司已于2019年已經上市了全基因型的丙肝治療產品,此次注銷的是第一代產品,只能用于基因1b型治療,且申請注銷是全球統一行動,“在中國,留下最好的就行了。”
對于默沙東來說,此次注銷磷酸西格列汀片注冊證書,則可能跟集采政策直接相關。磷酸西格列汀片是一款強效、高選擇性的二肽基肽酶-4(DPP-4)抑制劑,用于改善2型糖尿病患者的血糖控制。目前該產品在國內銷售超過10億元。默沙東作為磷酸西格列汀片的原研廠家,此次注銷了旗下涉及該產品的6個注冊證。
記者在國家藥監局官網查詢發現,目前國內共有7個磷酸西格列汀片的注冊證書,涉及浙江醫藥、廣東東陽光、石藥集團歐意藥業、正大天晴4家公司,且這7個產品均通過了仿制藥一致性評價。顯然,磷酸西格列汀片已經具備進入集采的前提條件。這意味著一旦磷酸西格列汀片被納入集采,默沙東就有可能面臨著國內仿制藥在價格上的拼殺。提前注銷藥品注冊證,實則是選擇了提前離場。
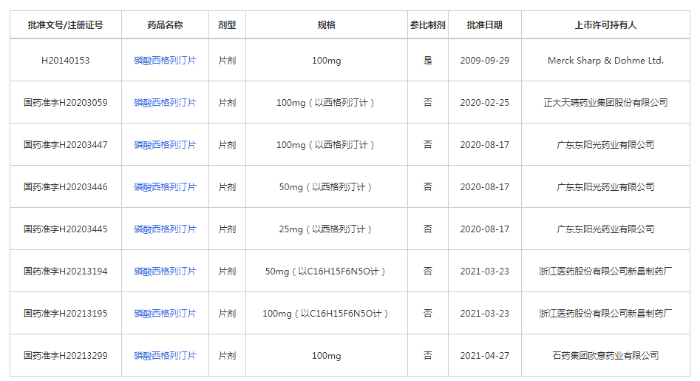
圖2為磷酸西格列汀片通過仿制藥一致性評價的目錄。(數據來源:國家藥監局官網)
有業內人士表示,跨國藥企如果有產品集采中標,如果因為價格低等原因想要注銷注冊證,一般不被允許。近日,第五批集采目錄公布,磷酸西格列汀片尚未被納入。
此次楊森主動注銷的琥珀酸普蘆卡必利片是第三批集采品種,楊森的原研藥并未中標(中選的企業分別為石家莊四藥、江蘇豪森藥業、河北仁合益康藥業)。公開資料顯示,第三批集采后,楊森在多省撤銷該產品掛網。
不難看出,隨著我國仿制藥一致性評價持續推進以及國家集采常態化,跨國藥企會隨之調整經營策略以及產品結構,過了專利期的原研藥將逐步退出。
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:宋佳薇)
右鍵點擊另存二維碼!
-
相關閱讀
-
為你推薦
-

-

每周醫藥看點(9月22日—28日)
國家藥監局藥品和醫療器械審評檢查京津冀分中心、華中分中心、西南分中心掛牌成立;市場監管總局辦公廳、工業和信息化部辦公廳聯合發布通知,公開征集2025年度計量支撐產業新質生產力發展項目,... 2025-09-28 14:16
互聯網新聞信息服務許可證10120170033
網絡出版服務許可證(京)字082號
?京公網安備 11010802023089號 京ICP備17013160號-1
《中國醫藥報》社有限公司 中國食品藥品網版權所有










