我國藥用輔料行業成長空間預計超2000億元
- 2021-05-12 09:41
- 作者:史海燕
- 來源:火石創造
藥用輔料是指藥物制劑中除主藥以外的一切成分的統稱,藥用輔料來源廣泛,品類繁多,從藥物制劑的組成成分來講,藥用輔料占比通常在80%以上。同時藥用輔料并非藥物發揮療效的核心成分,但它具有賦形、充當載體、提高藥品穩定性、增溶、助溶、緩控釋等重要功能,是可能會影響到制劑質量、安全性和有效性的重要成分。
藥用輔料分類
根據《中國藥典》,藥用輔料主要有三種分類方式。一是根據來源分類:藥用輔料可分為天然藥用輔料、半合成藥用輔料和全合成藥用輔料。二是根據給藥途徑分類:藥用輔料可分為口服、注射、黏膜、經皮或局部給藥、經鼻或口腔吸入給藥、眼部給藥等藥用輔料。同一種藥用輔料可用作不同的給藥途徑,且具有不同的功能。三是根據用途分類:藥用輔料可分為溶媒、拋射劑、增溶劑、組溶劑、乳化劑、著色劑、粘合劑、崩解劑、填充劑、潤滑劑、助懸劑、成膜劑、芳香劑、穩定劑、吸附劑、柔軟劑、保濕劑等十幾種類型。
藥用輔料作用
輔料是制劑的基礎材料和重要組成部分,在制劑生產中起著關鍵作用,且對藥品的安全性和有效性有直接影響。其作用主要分為三個方面。首先是輔料的賦型作用:藥品必須通過輔料形成劑型后方能發揮療效,根據加入輔料的不同,藥物制劑可被分為液體制劑(如溶液劑、注射劑等)、固體制劑(如片劑、膠囊劑等)、半固體制劑(如軟膏劑、凝膠劑等)和氣體制劑(如氣霧劑、噴霧劑等)。其次輔料可影響藥物功效:同一藥物因使用不同輔料制備成不同的制劑,可使其功效發生變化。如胰酶制備成腸溶衣片口服,可助脂肪消化;若制備成注射液對胸腔積液、血栓性靜脈炎和毒蛇咬傷有明顯療效。最后輔料可影響藥物吸收:輔料與藥物的吸收率和吸收量有密切聯系,例如以脫乙酰殼多糖為材料制備的吲哚美辛凝膠骨架微粒填入膠囊后,體內藥動研究表明該法可避免血藥濃度的尖峰,從而平穩維持較長時間。
行業發展規模
我國藥用輔料行業起步較晚,根據國家統計局公布的生物醫藥行業收入,以4%為輔料相關價值測算,我國藥用輔料市場目前規模在632億元左右,相比于海外成熟市場,預計還有逾2000億元的成長空間。從產業規模來看,國外藥用輔料占整個藥品制劑產值的10%-20%,而國內藥用輔料在整個藥品中占比較低,僅在3%-5%左右。
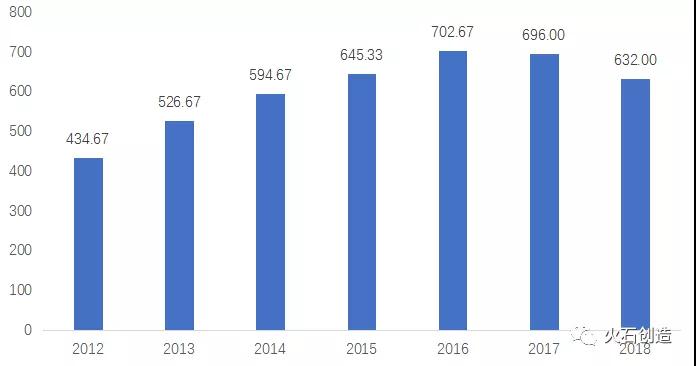
圖1:我國藥用輔料行業規模(億元)
來源:火石創造數據庫
國內藥用輔料行業集中度較低。目前我國藥用輔料生產企業共約470家,主要分為專門從事輔料生產的企業、化工企業和食品生產企業。專業藥用輔料企業數量占比較小且大部分企業規模較小,生產品種單一,銷售額在億元以上的僅山河藥輔、威爾藥業、爾康制藥等。整體而言,國內藥用輔料市場還有較大的成長空間。
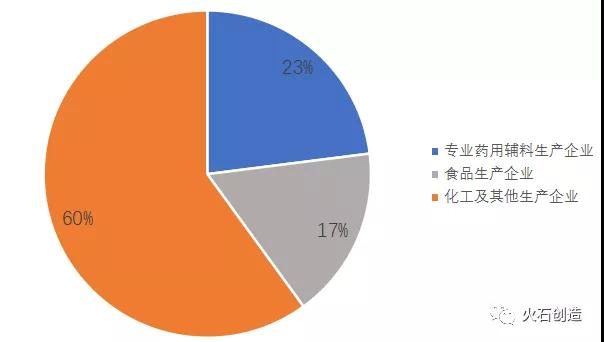
圖2:藥用輔料相關企業類型
來源:山河藥鋪招股說明書
從藥用輔料發展歷程來看,藥用輔料的發展與藥品制劑工業的發展一脈相承,海外發達的制劑產業造就了藥用輔料的發展,而國內藥用輔料則發展緩慢,品種較少。
目前我國藥用輔料數量為540余種,《中國藥典》收納的輔料標準已從2010年版的132種增加到2020版的335種,但種類仍處于較低水平,而美國和歐洲正在使用的藥用輔料品種數量分別約為1500種、3000種,收錄的藥用輔料標準分別約為750種和1500種。在輔料的品種和規格型號上,我國藥用輔料仍待發展。
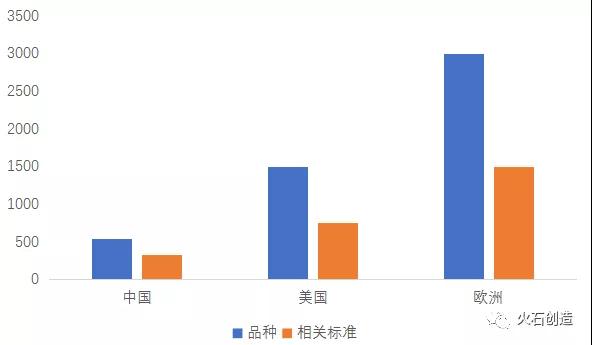
圖3:中國和歐美的輔料品種數量及相關標準
來源:根據公開資料整理
行業產業鏈
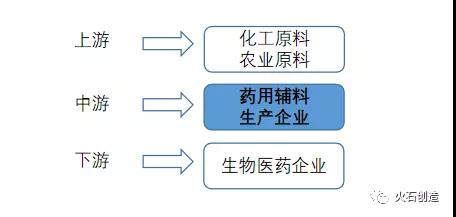
圖4:藥用輔料行業產業鏈
來源:根據公開資料整理
藥用輔料行業上游原材料眾多,具體可分為兩類,第一類為化工類企業提供基礎化工類原材料,如氯乙酸、乙醇等;第二類為農林企業提供農林類原材料,如木漿、玉米淀粉等。
現如今,我國基礎化工原料行業參與企業已逾300家,主要分布在中部、西部等資源豐富地區,整體呈現出產能過剩的局面,對中游藥用輔料生產企業的議價能力較弱。隨著城鎮化的推進、務農人數減少等原因,中國農林行業呈現龍頭集聚發展趨勢,在此背景下,中游生產企業可規模化采購降低采購成本,同時可擁有穩定的上游供應鏈。
藥用輔料中游生產企業可分為粗獷型低端藥用輔料和精細型高端藥用輔料兩類。前者多為化工企業或食品加工企業,原材料加工處理工藝簡單,同質化競爭嚴重,行業壁壘低;后者主要為從事藥用輔料生產的制藥企業,擁有較高的技術含量,該類企業通過改進生產工藝獲得高端藥用輔料,在行業競爭中優勢明顯。
藥用輔料下游主要為制藥企業,從成本結構來看,藥用輔料雖然用量占藥品80%,但藥品成本占比不超7%,成本占比較少,藥用輔料價格波動對藥品價格影響較小。從議價能力上看,制藥領域是藥用輔料最主要的銷售方向,中游藥用輔料企業對下游制藥企業依賴程度較高,藥用輔料企業整體議價能力較弱。伴隨著一致性評價及關聯審批政策的落地,下游制藥企業對藥用輔料的質量要求逐漸提高,大型專業從事藥用輔料生產企業的議價能力有望提高。
行業發展趨勢
行業集中度提升,行業格局也將重塑。2016年8月,原國家食藥監總局發布《關于藥包材藥用輔料與藥品關聯審評審批有關事項的公告》,明確規定藥用輔料不再單獨審批,而是關聯藥品注冊申請時一并審評審批,對藥用輔料質量提出了新要求,將過去孤立、分散的藥用輔料與制劑相關聯,統一在一個平臺管理,這就意味著藥用輔料的質量很大程度上將決定制劑審批結果。
此外,關聯審批明確了責任主體,制劑企業對藥用輔料的使用負責,因此會優先選擇和提供質量高、安全性有保障的藥用輔料的供應商進行合作,一些質量差、生產不規范的企業將會陸續出局,這將極大帶動藥用輔料行業產品質量提升,行業集中度也有望進一步提升。同時,具有產品和技術優勢的企業將會加速搶占市場份額,淘汰小、差、不規范的藥用輔料生廠商,行業競爭格局將有望得到重塑。
監管逐漸與國際接軌。目前,在新修訂《藥品管理法》施行背景下,我國對藥用輔料的監管審評將逐漸與歐美國家接軌。從共同審評審批制度的細分規則來看,國內相關政策與美國DMF政策較為接近,更強調將藥品視為由原料藥、藥包材、輔料組成的有機整體,而輔料的監管相對更為接近備案制,強調制劑企業的主體責任,有利于激活輔料企業的研發積極性。
輔料質量要求逐漸提升,利好優質藥用輔料企業。仿制藥一致性評價的核心是藥物制劑的處方和工藝,作為藥物制劑處方重要組成部分的藥用輔料,雖然并無生理活性,但是和藥物發生相互作用會產生配伍禁忌,而且輔料的質量會直接影響制劑的質量、穩定性和療效,因此藥用輔料的篩選是仿制藥一致性評價的重要研究內容,從藥物的溶出到吸收,藥用輔料是影響藥品制劑溶出曲線和藥物代謝動力學的重要因素。
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:劉思慧)
右鍵點擊另存二維碼!
-
為你推薦












