每周醫藥看點(8月11日—17日)
- 2025-08-21 11:43
- 作者:劉鶴
- 來源:中國醫藥報
國家醫保局對2025年國家醫保藥品目錄初步形式審查結果進行公示,534個藥品通過形式審查;國家藥監局藥品審評中心(CDE)發布《骨關節炎新藥臨床研發技術指導原則》,鼓勵骨關節炎創新藥物研發……8月11日—17日,醫藥行業的這些動態值得關注。
行業政策及藥監動態
1.國家醫保局發布《關于公示通過2025年國家基本醫療保險、生育保險和工傷保險藥品目錄及商保創新藥目錄調整初步形式審查的藥品及相關信息的公告》。公告顯示,2025年共有534個藥品通過基本醫保目錄初步形式審查,121個藥品通過商保創新藥目錄初步形式審查。
2.CDE發布《骨關節炎新藥臨床研發技術指導原則》,鼓勵針對骨關節炎這一疾病潛在病理生理和結構進展的創新藥物開發。指導原則僅適用于按化學藥品和治療用生物制品研發的治療藥物,不包括細胞治療和基因治療產品。
3.CDE就《罕見病用化學藥物藥學研究指導原則(征求意見稿)》公開征求意見。制定該指導原則,旨在提高罕見病藥物研發效率,鼓勵和加速推動罕見病藥物研發上市。
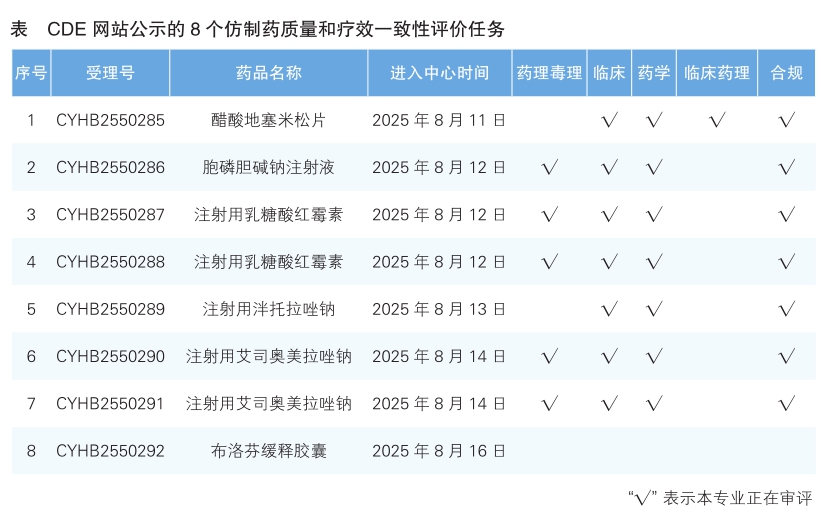
4.CDE網站公示8個仿制藥質量和療效一致性評價任務(詳見表),涉及醋酸地塞米松片等品種。
產品研發上市信息
1.國家藥監局發布5期藥品批準證明文件送達信息,共包括121個受理號,涉及湖南洞庭藥業股份有限公司等企業。
2.CDE承辦受理56個新藥上市申請,包括司美格魯肽注射液等。
3.亞盛醫藥宣布,公司自主研發的Bcl-2選擇性抑制劑利沙托克拉聯合阿扎胞苷治療新診斷的中高危骨髓增生異常綜合征患者的全球注冊Ⅲ期臨床試驗獲美國食品藥品管理局(FDA)和歐洲藥品管理局(EMA)批準。
4.啟函生物宣布,公司研發的通用型雙靶點CAR-T細胞療法(QT-019B)的新藥臨床試驗申請已獲得美國FDA批準,計劃在美國開展QT-019B治療難治性系統性紅斑狼瘡的臨床試驗。
5.紐倫捷生物宣布,公司研發的基于原位轉分化技術的創新藥NRG-103注射液的新藥臨床試驗申請已獲得美國FDA批準,可正式開展針對膠質母細胞瘤的臨床研究。
醫藥企業觀察
1.北海康成宣布與百洋醫藥達成股份認購協議,百洋醫藥將以每股1.34港元的價格認購北海康成價值約1億港元的股份。同時,北海康成與百洋醫藥簽署一項獨家商業服務協議。根據該協議,百洋醫藥旗下子公司將獲得北海康成旗下特定產品在許可區域的推廣權。
2.復星醫藥宣布,其控股子公司上海復星醫藥產業發展有限公司與美國生物技術公司Expedition?Therapeutics,Inc.簽訂許可協議,授予Expedition小分子口服二肽基肽酶1抑制劑XH-S004在許可區域的開發、生產及商業化權利。根據協議,Expedition將向復星醫藥支付最高1.2億美元的不可退還首付款、開發及監管里程碑付款;未來還將基于XH-S004在許可區域的年度凈銷售額的達成情況,支付最高5.25億美元的銷售里程碑款項。
3.京東健康宣布,與知原藥業簽署戰略合作協議。雙方將聚焦皮膚健康領域,在醫藥供應鏈、全域營銷、跨境藥品等方面展開合作。知原藥業將其仿制藥吡美莫司軟膏的獨家核心包銷權授予京東健康,并持續加碼京東生態平臺的站內外全鏈路資源投入。
4.步長制藥發布公告稱,公司控股子公司山東丹紅制藥有限公司擬與山東中醫藥大學附屬醫院簽署《技術轉讓(開發)合同》,以1500萬元人民幣的價格受讓山東中醫藥大學附屬醫院擁有的中藥二至調經優化方技術所有權,用于新藥開發。
藥品集中采購
1.廣東省藥品交易中心發布《廣東聯盟常見病慢性病藥品接續采購文件》(以下簡稱《文件》),開展廣東聯盟常見病慢性病藥品接續采購工作。根據《文件》,提供藥品及伴隨服務的國內藥品生產企業、國內藥品上市許可持有人、境外藥品上市許可持有人境內代理人,在質量標準、生產能力、供應穩定性、企業信用等方面達到本次接續集采要求的均可參加。本次接續集采品種范圍包括阿米卡星等品種;采購周期原則上為兩年,自中選結果實際執行日起計算,首年采購期截至2026年12月31日。
2.山西省醫保局發布《山西省醫療保障信息平臺藥品掛網規則(試行)》,自2025年10月1日起施行。在價格聯動方面,要求新增掛網藥品需提供申報產品全國掛網價格最低的六個省級平臺掛網價。申報掛網價格不得高于全國省級平臺最低掛網價。如新增掛網產品為國家組織集采藥品未中選的同通用名同劑型原研藥品、參比制劑、通過一致性評價藥品,申報掛網價格不得高于“上海市梯度降價”結果。
3.上海市醫藥集中招標采購事務管理所發布《關于開展全國中成藥采購聯盟集中采購(ZCYLM-2024-2)中選品種申報掛網工作的通知》,上海將對全國中成藥集采首批擴圍接續藥品進行掛網,申報掛網時間為2025年8月12日至8月29日。(劉鶴整理)
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:劉思慧)
右鍵點擊另存二維碼!
-
相關閱讀
-
為你推薦