每周醫(yī)藥看點(diǎn)(9.24-10.7)
- 2021-10-08 14:56
- 作者:劉思慧
- 來(lái)源:中國(guó)食品藥品網(wǎng)
中國(guó)食品藥品網(wǎng)訊 國(guó)務(wù)院辦公廳印發(fā)《“十四五”全民醫(yī)療保障規(guī)劃》;《體外診斷試劑臨床試驗(yàn)技術(shù)指導(dǎo)原則》《醫(yī)療器械臨床評(píng)價(jià)技術(shù)指導(dǎo)原則》等文件發(fā)布;蘆薈珍珠膠囊由處方藥轉(zhuǎn)化為非處方藥……9月24日-10月7日,醫(yī)藥行業(yè)的這些事情值得關(guān)注。
行業(yè)政策動(dòng)態(tài)
1.國(guó)務(wù)院辦公廳印發(fā)《“十四五”全民醫(yī)療保障規(guī)劃》,涉及15個(gè)指標(biāo),包括參保覆蓋率、基金安全、保障程度、精細(xì)管理和優(yōu)質(zhì)服務(wù)。規(guī)劃提出,健全多層次醫(yī)療保障制度體系,提升基本醫(yī)療保險(xiǎn)參保質(zhì)量,優(yōu)化完善基本醫(yī)保待遇保障和籌資機(jī)制,鼓勵(lì)商業(yè)健康保險(xiǎn)和醫(yī)療互助發(fā)展,穩(wěn)步建立長(zhǎng)期護(hù)理保險(xiǎn)制度;優(yōu)化醫(yī)療保障協(xié)同治理體系,完善醫(yī)療保障支付機(jī)制和醫(yī)藥價(jià)格形成機(jī)制,加快健全基金監(jiān)管體制機(jī)制,協(xié)同建設(shè)高效的醫(yī)藥服務(wù)供給體系;構(gòu)筑堅(jiān)實(shí)的醫(yī)療保障服務(wù)支撐體系,健全醫(yī)療保障公共服務(wù)體系,強(qiáng)化法治支撐,推動(dòng)安全發(fā)展,加快醫(yī)保信息化建設(shè),健全標(biāo)準(zhǔn)化體系。
2.國(guó)家藥監(jiān)局正式致函藥品檢查合作計(jì)劃(PIC/S),申請(qǐng)啟動(dòng)預(yù)加入程序。預(yù)加入程序是加入PIC/S的一個(gè)步驟,旨在幫助申請(qǐng)者在提出正式申請(qǐng)前更好地理解PIC/S的相關(guān)要求。
3.國(guó)家藥監(jiān)局發(fā)布《免于臨床試驗(yàn)的體外診斷試劑臨床評(píng)價(jià)技術(shù)指導(dǎo)原則》,為申請(qǐng)人對(duì)免于臨床試驗(yàn)的體外診斷試劑臨床評(píng)價(jià)提供技術(shù)指導(dǎo),同時(shí)為藥品監(jiān)督管理部門(mén)對(duì)該部分資料的技術(shù)審評(píng)提供參考依據(jù)。
4.國(guó)家藥監(jiān)局發(fā)布《體外診斷試劑臨床試驗(yàn)技術(shù)指導(dǎo)原則》,明確體外診斷試劑臨床試驗(yàn)的基本原則和臨床試驗(yàn)中需要考慮的關(guān)鍵因素,并對(duì)臨床試驗(yàn)質(zhì)量管理提出基本要求,以指導(dǎo)申辦者的臨床試驗(yàn)工作,為技術(shù)審評(píng)部門(mén)對(duì)臨床試驗(yàn)資料的審評(píng)提供參考。
5.國(guó)家藥監(jiān)局發(fā)布《醫(yī)療器械臨床評(píng)價(jià)技術(shù)指導(dǎo)原則》《決策是否開(kāi)展醫(yī)療器械臨床試驗(yàn)技術(shù)指導(dǎo)原則》《醫(yī)療器械臨床評(píng)價(jià)等同性論證技術(shù)指導(dǎo)原則》《醫(yī)療器械注冊(cè)申報(bào)臨床評(píng)價(jià)報(bào)告技術(shù)指導(dǎo)原則》和《列入免于臨床評(píng)價(jià)醫(yī)療器械目錄產(chǎn)品對(duì)比說(shuō)明技術(shù)指導(dǎo)原則》5項(xiàng)醫(yī)療器械臨床評(píng)價(jià)相關(guān)技術(shù)指導(dǎo)原則,為注冊(cè)申請(qǐng)人開(kāi)展醫(yī)療器械產(chǎn)品注冊(cè)工作和藥品監(jiān)管部門(mén)進(jìn)行技術(shù)審評(píng)提供指導(dǎo)。
6.國(guó)家藥監(jiān)局發(fā)布通告,新修訂《醫(yī)療器械注冊(cè)與備案管理辦法》《體外診斷試劑注冊(cè)與備案管理辦法》自今年10月1日起施行。根據(jù)通告,兩個(gè)辦法實(shí)施前已受理但尚未作出審批決定的注冊(cè)申請(qǐng)項(xiàng)目,藥品監(jiān)督管理部門(mén)按照原規(guī)定繼續(xù)審評(píng)審批,符合上市條件的,頒發(fā)醫(yī)療器械注冊(cè)證。兩個(gè)辦法實(shí)施前已受理但尚未作出審批決定的注冊(cè)申請(qǐng)項(xiàng)目,如補(bǔ)正材料涉及檢驗(yàn)報(bào)告,注冊(cè)申請(qǐng)人應(yīng)當(dāng)委托具有資質(zhì)的醫(yī)療器械檢驗(yàn)機(jī)構(gòu)出具補(bǔ)充檢驗(yàn)報(bào)告;如注冊(cè)申請(qǐng)人的體系核查涵蓋了檢驗(yàn)?zāi)芰Γ部梢园凑諆蓚€(gè)辦法及相關(guān)要求提交補(bǔ)充自檢報(bào)告。
7.國(guó)家藥監(jiān)局根據(jù)《醫(yī)療器械監(jiān)督管理?xiàng)l例》和《醫(yī)療器械注冊(cè)與備案管理辦法》,組織制定了《醫(yī)療器械注冊(cè)申報(bào)資料和批準(zhǔn)證明文件格式要求》《醫(yī)療器械注冊(cè)申報(bào)資料要求及說(shuō)明》《醫(yī)療器械延續(xù)注冊(cè)申報(bào)資料要求及說(shuō)明》《醫(yī)療器械變更備案/變更注冊(cè)申報(bào)資料要求及說(shuō)明》《醫(yī)療器械臨床試驗(yàn)審批申報(bào)資料要求及說(shuō)明》和《醫(yī)療器械安全和性能基本原則清單》等6份申報(bào)資料要求和批準(zhǔn)證明文件格式要求,同時(shí)發(fā)布了《中華人民共和國(guó)醫(yī)療器械注冊(cè)證(格式)》《國(guó)家藥品監(jiān)督管理局醫(yī)療器械臨床試驗(yàn)審批意見(jiàn)單(格式)》等3份醫(yī)療器械相關(guān)格式示例。
8.國(guó)家藥監(jiān)局發(fā)布公告,自2021年12月29日起,化學(xué)藥品注冊(cè)分類(lèi)1類(lèi)、5.1類(lèi),以及治療用生物制品1類(lèi)和預(yù)防用生物制品1類(lèi)的上市許可申請(qǐng),可按照藥品電子通用技術(shù)文檔(eCTD)進(jìn)行申報(bào)。
9.國(guó)家藥監(jiān)局再次就《化妝品不良反應(yīng)監(jiān)測(cè)管理辦法(征求意見(jiàn)稿)》公開(kāi)征求意見(jiàn)。本次征求意見(jiàn)稿進(jìn)一步明確了化妝品注冊(cè)人、備案人不良反應(yīng)監(jiān)測(cè)的主體責(zé)任,不良反應(yīng)分級(jí)分類(lèi)管理原則,各級(jí)化妝品不良反應(yīng)監(jiān)測(cè)機(jī)構(gòu)的職責(zé)分工和工作要求,完善不良反應(yīng)風(fēng)險(xiǎn)信號(hào)調(diào)查處置要求。
10、國(guó)家藥監(jiān)局發(fā)布公告稱(chēng),國(guó)內(nèi)已上市的順鉑注射劑、注射用異環(huán)磷酰胺、硫唑嘌呤片、注射用門(mén)冬酰胺酶和注射用硫酸長(zhǎng)春地辛5個(gè)抗腫瘤藥品相應(yīng)規(guī)格可以參照公告要求,遞交修訂說(shuō)明書(shū)的補(bǔ)充申請(qǐng),增補(bǔ)兒童用藥信息。
11.國(guó)家藥監(jiān)局發(fā)布公告,將蘆薈珍珠膠囊(每粒裝0.5克)由處方藥轉(zhuǎn)化為非處方藥,并發(fā)布品種名單及非處方藥說(shuō)明書(shū)范本。
12.CDE就《口服固體制劑混合均勻度和中控劑量單位均勻度研究技術(shù)指導(dǎo)原則(征求意見(jiàn)稿)》《化學(xué)仿制藥晶型研究技術(shù)指導(dǎo)原則(征求意見(jiàn)稿)》《對(duì)我國(guó)<以藥動(dòng)學(xué)參數(shù)為終點(diǎn)評(píng)價(jià)指標(biāo)的化學(xué)藥物仿制藥人體生物等效性研究技術(shù)指導(dǎo)原則>中關(guān)于多規(guī)格豁免BE藥學(xué)評(píng)價(jià)標(biāo)準(zhǔn)“處方比例相似性”相關(guān)問(wèn)題的問(wèn)答(征求意見(jiàn)稿二)》公開(kāi)征求意見(jiàn),征求意見(jiàn)截止日期為2021年10月25日;就《特立帕肽注射液生物類(lèi)似藥臨床試驗(yàn)設(shè)計(jì)指導(dǎo)原則(征求意見(jiàn)稿)》公開(kāi)征求意見(jiàn),征求意見(jiàn)截止日期為2021年10月29日。
產(chǎn)品研發(fā)/上市信息
1.國(guó)家藥監(jiān)局批準(zhǔn)惠州海卓科賽醫(yī)療有限公司生產(chǎn)的創(chuàng)新產(chǎn)品“水動(dòng)力治療設(shè)備”和“一次性使用清創(chuàng)水動(dòng)力刀頭”注冊(cè)申請(qǐng)。水動(dòng)力治療設(shè)備由主機(jī)、腳踏開(kāi)關(guān)、廢液桶、電源線、接地線構(gòu)成;一次性使用清創(chuàng)水動(dòng)力刀頭由輸液管組件、高壓管、廢液管組件、泵體及手柄組件組成。兩個(gè)產(chǎn)品配合使用,預(yù)期用于傷口清創(chuàng)(急性和慢性傷口、燒傷)、軟組織清創(chuàng)。該產(chǎn)品為首個(gè)利用高壓水動(dòng)力進(jìn)行清創(chuàng)治療的國(guó)產(chǎn)產(chǎn)品,為國(guó)內(nèi)首創(chuàng)。
2.國(guó)家藥監(jiān)局發(fā)布3期藥品批準(zhǔn)證明文件待領(lǐng)信息,共包括257個(gè)受理號(hào),涉及山東魯抗醫(yī)藥股份有限公司等企業(yè)。(截至10月7日)

3.國(guó)家藥監(jiān)局發(fā)布6期醫(yī)療器械批準(zhǔn)證明文件(準(zhǔn)產(chǎn))待領(lǐng)信息,共包括144個(gè)受理號(hào),涉及中山大學(xué)達(dá)安基因股份有限公司等企業(yè)。(截至10月7日)

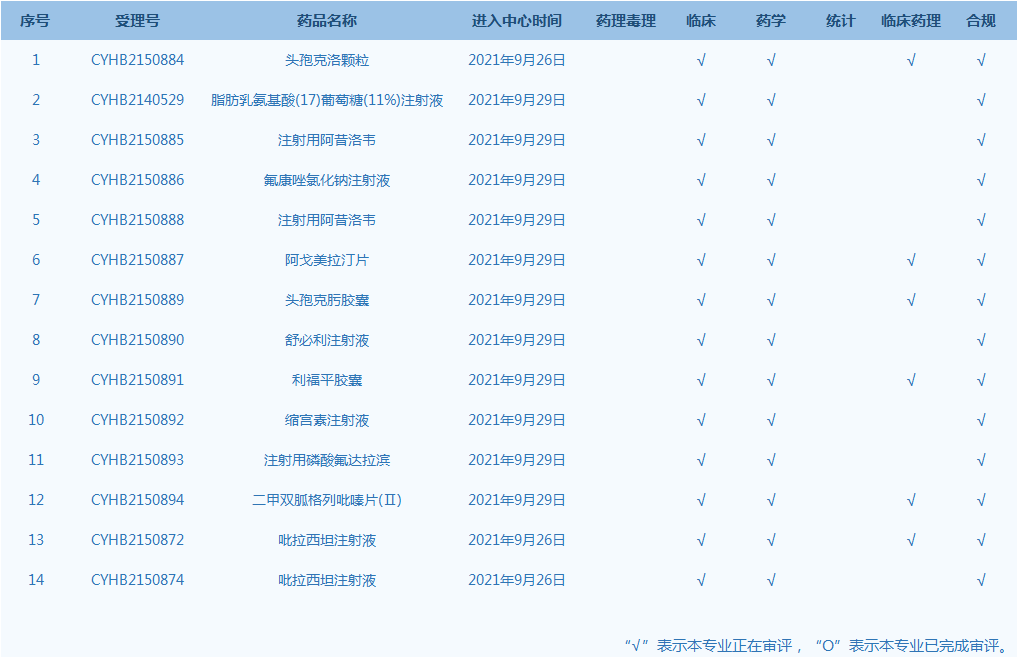
4.CDE網(wǎng)站公示14個(gè)仿制藥一致性評(píng)價(jià)任務(wù),涉及頭孢克洛顆粒等藥品。(截至10月7日)
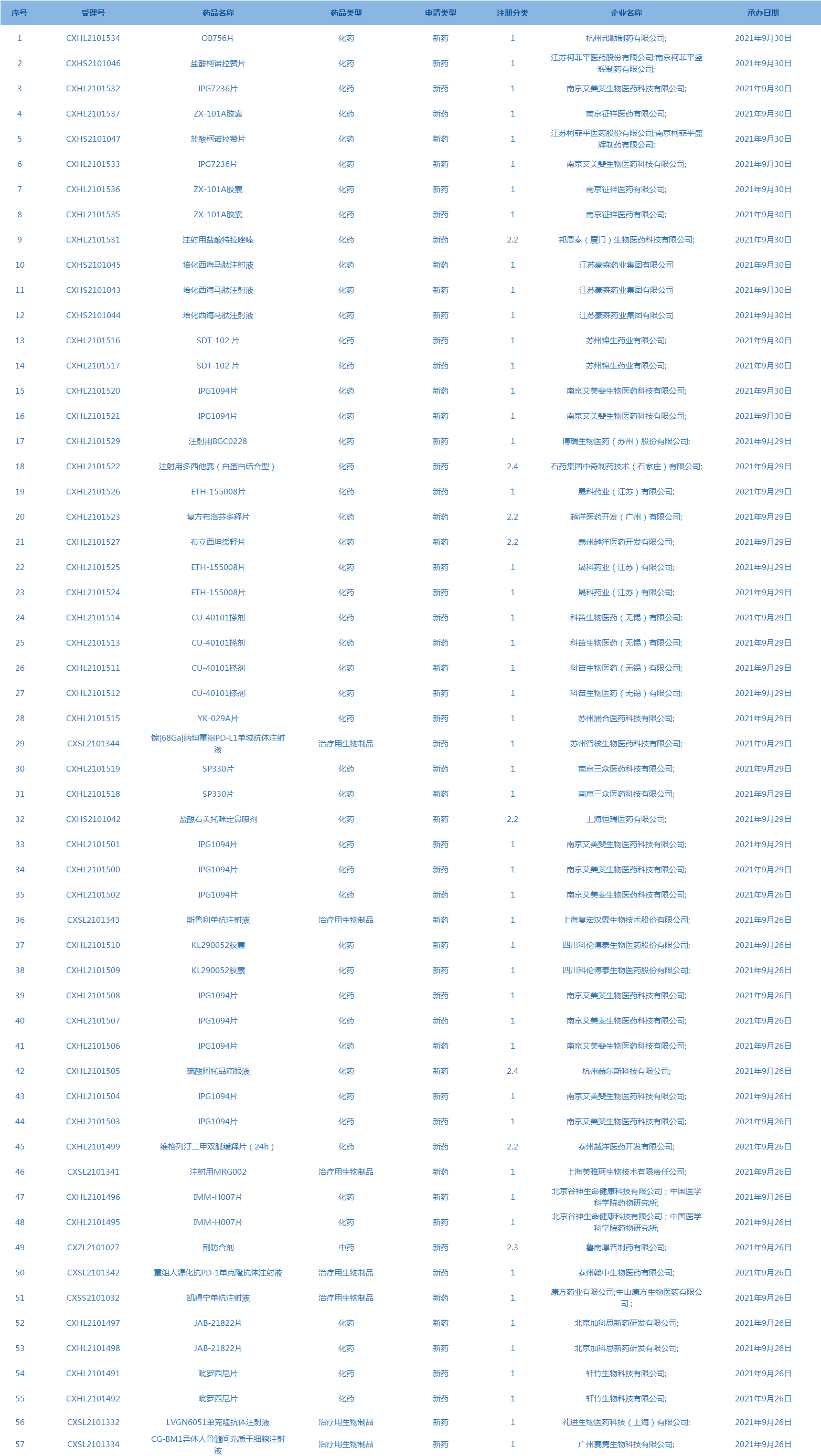
5.CDE承辦受理57個(gè)新藥上市申請(qǐng),包括鹽酸柯諾拉贊片等藥品。(截至10月7日)
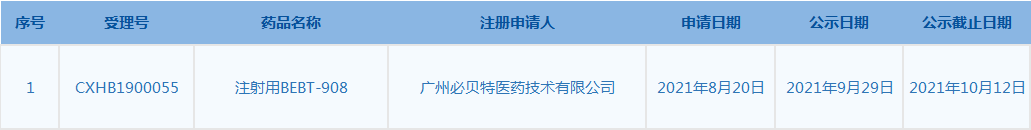
6.CDE網(wǎng)站信息顯示,注射用BEBT-908被列入擬突破性治療品種。(截至10月7日)
醫(yī)藥企業(yè)觀察
1.恒瑞醫(yī)藥發(fā)布公告稱(chēng),收到美國(guó)FDA關(guān)于同意注射用SHR-A1904治療晚期實(shí)體瘤臨床研究的函,公司將于近期開(kāi)展I/IIa期臨床試驗(yàn)。
2.信達(dá)生物與UNIONtherapeutics共同宣布,雙方就后者用于治療炎癥性皮膚病的主要候選藥物orismilast,達(dá)成在中國(guó)的獨(dú)家授權(quán)協(xié)議。這是一款處于臨床II期的潛在“best-in-class”P(pán)DE4抑制劑。根據(jù)協(xié)議,信達(dá)生物將獲得orismilast在中國(guó)研究、開(kāi)發(fā)和商業(yè)化的獨(dú)家權(quán)益。UNION公司將收到2000萬(wàn)美元的首付款,并有權(quán)獲得累計(jì)不超過(guò)2.47億美元的里程碑付款,以及orismilast在中國(guó)年度銷(xiāo)售凈額的特許權(quán)使用費(fèi)。
3.四環(huán)醫(yī)藥發(fā)布公告稱(chēng),附屬子公司軒竹生物與SignalChemLifesciences公司就AXL靶向抑制劑SLC-391在大中華區(qū)的開(kāi)發(fā)和商業(yè)化權(quán)益簽訂合作及許可協(xié)議。根據(jù)協(xié)議,軒竹生物向SignalChem支付1300萬(wàn)美元首付款,SignalChem未來(lái)有資格獲得包括開(kāi)發(fā)、注冊(cè)和商業(yè)化里程碑等付款以及分級(jí)銷(xiāo)售分成。四環(huán)醫(yī)藥將獲得SLC-391在大中華區(qū)獨(dú)家腫瘤治療領(lǐng)域各項(xiàng)適應(yīng)癥的研究、開(kāi)發(fā)、生產(chǎn)及商業(yè)化權(quán)利。
4.奇正藏藥計(jì)劃在拉薩建設(shè)區(qū)域總部基地——德堂林家園項(xiàng)目,項(xiàng)目總投資擬為50,000萬(wàn)元人民幣,該項(xiàng)目為集研發(fā)創(chuàng)新平臺(tái)、企業(yè)文化展示、辦公、藏醫(yī)特色康復(fù)及健康管理、藏藥材展示交易、專(zhuān)家及員工公寓為一體的基礎(chǔ)設(shè)施建設(shè),為公司自建自用項(xiàng)目。
5.軼諾藥業(yè)宣布完成數(shù)千萬(wàn)美元B輪融資,本輪融資由上海生物醫(yī)藥基金領(lǐng)投,山藍(lán)資本、提梁投資、華賽智康和尚實(shí)天信跟投,老股東張科領(lǐng)弋追加投資。
6.西比曼生物宣布,公司完成1.2億美元的A輪融資,由阿斯利康中金醫(yī)療產(chǎn)業(yè)基金、紅杉資本、云鋒基金共同領(lǐng)投,新加坡政府投資公司(GIC)、泰福資本等老股東跟投。本輪融資將主要用于推進(jìn)抗CD19/CD20雙靶點(diǎn)CAR-T療法——C-CAR039未來(lái)在中國(guó)和美國(guó)的臨床研究,以及加速靶向BCMA的CAR-T療法——C-CAR088針對(duì)多發(fā)性骨髓瘤的臨床開(kāi)展。
7.創(chuàng)勝集團(tuán)于9月29日在港交所正式上市。該公司是一家集發(fā)現(xiàn)、研究、開(kāi)發(fā)、制造及業(yè)務(wù)拓展能力為一體的臨床階段生物醫(yī)藥公司。公開(kāi)信息顯示,此次創(chuàng)勝集團(tuán)在港交所上市,每股發(fā)行價(jià)為16港元,預(yù)計(jì)全球發(fā)售所得款項(xiàng)凈額約為5.74億港元,基石投資者有LAV、淡馬錫、QIA、中國(guó)國(guó)有企業(yè)結(jié)構(gòu)調(diào)整基金等。
藥械集中采購(gòu)
1.湖北省醫(yī)藥價(jià)格和招標(biāo)采購(gòu)管理服務(wù)網(wǎng)發(fā)布《中成藥省際聯(lián)盟集中帶量采購(gòu)公告(第1號(hào))》,明確由湖北、河北、山西、內(nèi)蒙古、遼寧、福建、江西、河南、湖南、海南、重慶、四川、貴州、西藏、陜西、甘肅、寧夏、新疆、新疆生產(chǎn)建設(shè)兵團(tuán)等聯(lián)盟地區(qū)委派代表組成中成藥省際聯(lián)盟聯(lián)采辦,代表各地區(qū)公立醫(yī)療機(jī)構(gòu)(含軍隊(duì)醫(yī)療機(jī)構(gòu))及自愿參加的醫(yī)保定點(diǎn)社會(huì)辦醫(yī)療機(jī)構(gòu)和定點(diǎn)藥店實(shí)施中成藥集中帶量采購(gòu),由湖北省醫(yī)保局承擔(dān)聯(lián)采辦日常工作并負(fù)責(zé)具體實(shí)施。采購(gòu)范圍為臨床使用量大、采購(gòu)金額高、多家企業(yè)生產(chǎn)的中成藥品。根據(jù)產(chǎn)品的功能主治、給藥途徑和成分,將此次采購(gòu)藥品劃分為17個(gè)產(chǎn)品組,共計(jì)76個(gè)藥品。
2.上海市醫(yī)保局發(fā)布《關(guān)于進(jìn)一步完善本市定點(diǎn)藥店藥品價(jià)格和中藥飲片、配方顆粒“陽(yáng)光采購(gòu)”管理有關(guān)事項(xiàng)的通知》,對(duì)醫(yī)保定點(diǎn)零售藥店藥品價(jià)格管理,定點(diǎn)醫(yī)療機(jī)構(gòu)中藥飲片及配方顆粒“陽(yáng)光采購(gòu)”管理等方面內(nèi)容做了明確的規(guī)定。
3.江西省藥品醫(yī)用耗材集中采購(gòu)聯(lián)席會(huì)議辦公室發(fā)布《贛粵豫鄂四省聯(lián)盟藥品帶量采購(gòu)文件(JX-YP2021-01)》,涉及10個(gè)品種36個(gè)品規(guī),并公布了首年約定采購(gòu)量。聯(lián)盟地區(qū)包括:江西、廣東、河南、湖北,由江西省藥品醫(yī)用耗材集中采購(gòu)聯(lián)席會(huì)議辦公室承擔(dān)日常工作并具體實(shí)施。
4.廣東省藥品交易中心就《廣東聯(lián)盟雙氯芬酸等153個(gè)藥品集團(tuán)帶量采購(gòu)文件(征求意見(jiàn)稿)》公開(kāi)征求意見(jiàn),涉及153個(gè)品種,包括血液制品3個(gè)、基礎(chǔ)輸液4個(gè)和其他藥品146個(gè),其中50個(gè)為獨(dú)家品種(分組后)。
5.湖南公共資源交易中心發(fā)布《關(guān)于做好湖南省2021年抗菌藥物專(zhuān)項(xiàng)集中采購(gòu)相關(guān)藥品補(bǔ)標(biāo)及跟標(biāo)工作的通知》。其中補(bǔ)標(biāo)范圍包括2021年度抗菌藥物專(zhuān)項(xiàng)集采擬續(xù)約藥品中不續(xù)約藥品、2019年抗菌藥物專(zhuān)項(xiàng)集采價(jià)格糾偏時(shí)第四質(zhì)量層次棄標(biāo)藥品,共涉及13個(gè)品種。【中國(guó)食品藥品網(wǎng)綜合整理/劉思慧】
《中國(guó)醫(yī)藥報(bào)》社版權(quán)所有,未經(jīng)許可不得轉(zhuǎn)載使用。
(責(zé)任編輯:劉思慧)
×
右鍵點(diǎn)擊另存二維碼!
-
相關(guān)閱讀
網(wǎng)民評(píng)論
歡迎
登錄
-
為你推薦
-
熱點(diǎn)排行
- 2025年版《中國(guó)藥典》藥用輔料新增品種標(biāo)準(zhǔn)...
- 福建省藥監(jiān)局福州稽查辦監(jiān)督銷(xiāo)毀1.09余噸假...
- 吉林省藥監(jiān)局舉辦全省藥品流通監(jiān)管人員業(yè)務(wù)...
- 藥監(jiān)“溫度”賦能產(chǎn)業(yè)“高度” 青海省醫(yī)...
- 世界藥師日丨致敬你身邊的用藥守護(hù)者
- 巔峰對(duì)決展風(fēng)采藥物警戒護(hù)安全——2025年山...
- 每周醫(yī)藥看點(diǎn)(9月22日—28日)
- 湖南省藥監(jiān)局召開(kāi)全省中藥飲片生產(chǎn)企業(yè)落實(shí)...
- 探索構(gòu)建罕見(jiàn)病診療與保障的“中國(guó)模式”
- 福建省藥監(jiān)局開(kāi)展“網(wǎng)絡(luò)安全進(jìn)社區(qū)”活動(dòng)守...
互聯(lián)網(wǎng)新聞信息服務(wù)許可證10120170033
網(wǎng)絡(luò)出版服務(wù)許可證(京)字082號(hào)
?京公網(wǎng)安備 11010802023089號(hào) 京ICP備17013160號(hào)-1













