自查報告填報系統開放至4月23日:15個藥品面臨臨床試驗數據核查
- 2019-04-16 09:45
- 作者:落楠
- 來源:中國健康傳媒集團-中國食品藥品網
中國食品藥品網訊(記者落楠) 4月4日,國家藥監局發布公告,決定對新收到的15個已完成臨床試驗申報生產的藥品注冊申請進行臨床試驗數據核查。4月10日,國家藥監局食品藥品審核查驗中心發布通告,對相關品種藥品注冊申請人開放藥物臨床試驗數據自查報告填報系統。

藥物臨床試驗數據自查報告填報系統開放
按照核查中心發布的《關于開放藥物臨床試驗數據自查報告填報系統的通告》,藥品注冊申請人應于2019年4月10日~4月23日,登錄核查中心網站(www.cfdi.org.cn ),在公眾服務區域選擇“網上辦事”中的“在線填報”,點擊“臨床試驗數據自查報告填報”,或者直接訪問網址:http://218.240.145.204:9082/esa/login_scqy.jsp,進行填報。逾期不報,將不安排現場核查。
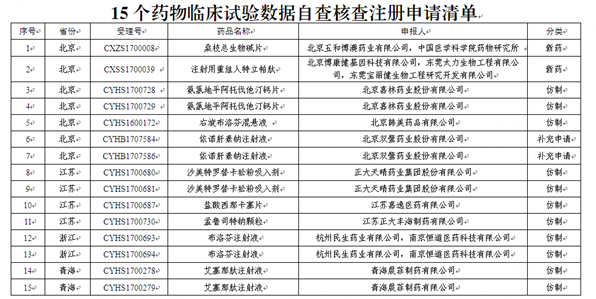
面臨臨床試驗數據核查的15個藥品
據悉,此次面臨核查的15個藥品,包括2個新藥和多個有望沖擊國內首仿的仿制藥,涉及北京嘉林藥業股份有限公司、北京雙鷺藥業股份有限公司、正大天晴藥業集團股份有限公司等企業。按照國家藥監局的公告,在國家藥監局組織核查前,藥品注冊申請人自查發現藥物臨床試驗數據存在真實性問題的,應主動撤回注冊申請,國家藥監局公布其名單,不追究其責任。
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:)
×
右鍵點擊另存二維碼!
網民評論
歡迎
登錄
-
為你推薦
-

-

互聯網新聞信息服務許可證10120170033
網絡出版服務許可證(京)字082號
?京公網安備 11010802023089號 京ICP備17013160號-1
《中國醫藥報》社有限公司 中國食品藥品網版權所有










