以飛檢推動器械企業持續落實GMP
- 2018-01-18 11:34
- 作者:張小岑
- 來源:中國健康傳媒集團-中國醫藥報
中國醫藥報記者 張小岑 報道 飛行檢查是食品藥品監管部門針對行政相對人開展的不預先告知的監督檢查,具有突擊性、獨立性、高效性等特點,在調查問題、管控風險、震懾違法行為等方面發揮著越來越重要的作用。
1月13日,在由廣東省食品藥品審評認證技術協會等主辦的第二屆食品藥品審評認證技術高峰會議上,廣東省食品藥品監管局醫療器械安全監管處副處長趙廣宇表示,飛行檢查的目的其實是想幫助企業對《醫療器械生產質量管理規范》(以下簡稱“GMP”)有更深入的理解,提高其對GMP的掌握和執行水平,最終提升整個醫療器械行業的質量管理水平。
嚴格隨機抽查 規范結果發布
2015年,國家食品藥品監管總局頒布了《藥品醫療器械飛行檢查辦法》,明確要求按照依法獨立、客觀公正、科學處置的原則,圍繞安全風險防控開展飛行檢查。2016年12月,在《總局關于進一步做好食品藥品安全隨機抽查加強事中事后監管的通知》中又提出,穩步推進食品藥品監管“雙隨機、一公開”(隨機抽取檢查對象、隨機選取檢查人員、抽取情況及查處結果及時向社會公開)的隨機抽查制度,進一步強化食品藥品安全事中事后監管。
據國家食藥監總局食品藥品審核查驗中心(以下簡稱“核查中心”)醫療器械核查處處長王愛君介紹,2017年國家食藥監總局的飛行檢查更為嚴格地遵循“雙隨機、一公開”的原則,并按產品風險等級分類監管,將“必須檢查”和“隨機抽查”有機結合——有嚴重事件必須查,還要有雙隨機抽查。
為了保證飛檢工作的深入開展和規范化實施,監管部門建立起檢查對象名錄庫和檢查人員名錄庫。王愛君介紹,在工作中還建立了隨機抽查工作規范。明確檢查事項和檢查人員的抽查基數、抽查比例、抽查方式、操作流程,突出隨機抽查的可操作性和實效性,確保抽查程序和結果的公平公正。
此外,合理確定隨機抽查比例和頻次。對納入重點抽查的,增加抽查的比例和頻次,加大隨機抽查力度。“需要明確的是,對守法經營、信譽好的企業,可適當降低抽查比例和頻次。但有的誠信企業有一些新產品,而且產品本身風險較高,2017年也被作為飛行檢查的重點。”王愛君表示。
隨著國家食藥監總局越發重視飛檢結果發布的實效性、規范性,2016年發布的《醫療器械飛行檢查信息發布程序》明確規定,檢查結束后,應當在2日內向核查中心提交檢查報告、現場檢查缺陷表及檢查記錄等工作文件。檢查組對檢查報告負責。核查中心將上述文件以公文的形式,于3日內報國家食藥監總局醫療器械監管司。對于在飛行檢查中發現企業存在的問題,器械監管司在國家食藥監總局網站專題專欄中予以通報,同時發布的還有檢查組現場檢查缺陷表。
王愛君提醒,現場檢查缺陷表需要企業簽字確認,如果企業有異議,包括檢查過程、檢查問題、相關數據檢查結果和處理意見,都可以在異議項標注出來。核查中心會根據具體情況特事特辦,不受時間限制。
提升企業認知 持續落實規范
當前,我國醫療器械產品質量面臨的最突出問題就是產品性能的穩定性和持續性。“我國醫療器械監管理念已經轉變為重視過程監管,飛行檢查的目的就是要讓各個企業落實GMP保持常態化。企業要明確,產品質量是生產出來的,絕不是靠一個名頭、名號就能夠保證的。”趙廣宇根據廣東省2017年飛行檢查實際及近兩年對企業摸底的情況,分析了檢查中企業容易出現的兩種錯誤心態。
面對國家食藥監總局和省局組織的各層級飛行檢查,一些企業表現出敷衍、抵觸的心態,對檢查組的要求不配合。“態度不夠端正,企業肯定要被監管部門依照法規要求嚴肅處理的。”趙廣宇說。
另一種心態是企業主觀想做好生產質量體系管理,但由于自身能力問題,對GMP的理解和執行有一定的困難,特別是很多新企業。“想要對GMP有深入理解,就需要認真學習,達到融會貫通的目的,這是難度比較大的過程。”
“甚至我們一些監管人員對于GMP的某些理解也存在誤區。”趙廣宇強調說,“GMP其實是一個監管人員和企業對話的平臺,大家都站在一個尺度、一個標準上,所以增強溝通學習是十分必要的。”
飛行檢查是過程檢查,不同于注冊質量管理體系核查的靜態檢查。企業申報注冊的時候,產品還沒有大批量生產,這時候的核查只能證明企業是否能夠達到標準要求,而能否保證后續生產產品質量的持續性和穩定性,就要通過GMP來保證。
加大飛檢力度 突出風險管理
依據分級分類管理的原則,國家食藥監總局與省局的檢查項目必須分開。王愛君指出,高風險產品生產企業,比如由國家食藥監總局直接辦理案件中涉及的生產企業、產品貯存和運輸有特殊要求的經營企業、進口產品注冊代理人等都是2017年重點檢查目標。
王愛君介紹,2017年國家食藥監總局共派出133人次檢查員,組成41個檢查組,對79家醫療器械生產企業開展了飛行檢查,比2016年全年醫療器械生產企業的飛行檢查任務(51家)超出55%(見圖1)。其中有因檢查9家,合規檢查70家,合規檢查數占89%。
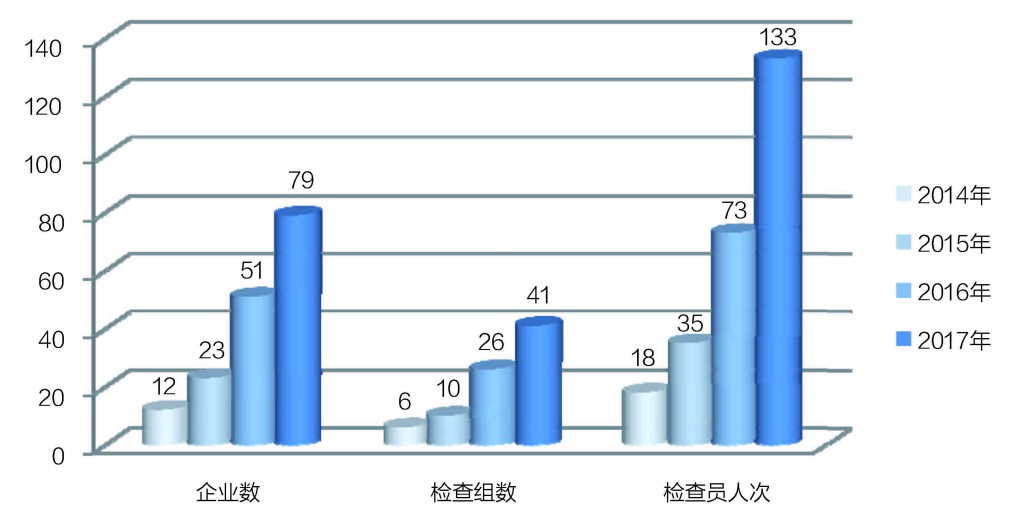
圖1 2014年~2017年年度分析
2014年~2017年,國家食藥監總局飛行檢查的企業數、檢查組數和檢查員人次數增長明顯。其中,檢查企業數從2014年的12家,增長到2017年的79家;檢查員人次數從2014年的18人次,增加到2017年的133人次。
2017年的79家器械生產企業從品種分配來看,生產無菌醫療器械產品的占39家,植入性醫療器械15家,體外診斷試劑7家,有源醫療器械產品10家,其他類8家;2016年這幾類品種分別為24家、9家、7家、7家和4家(見圖2)。“可以看出,2016年和2017年無菌器械產品都是飛檢的重中之重。”王愛君說。
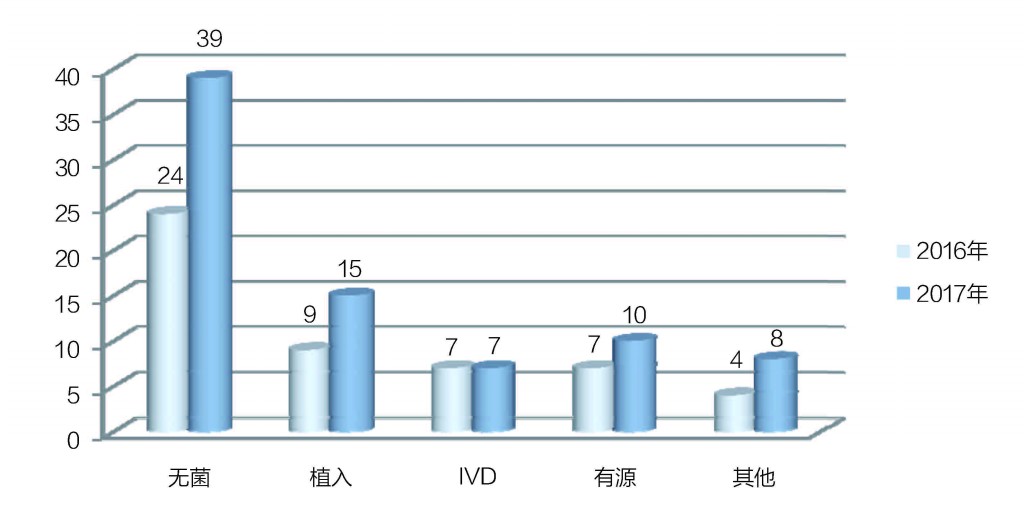
圖2 品種類別分布
就飛檢處理結果看,2017年停產整改了20家生產企業,占抽檢總數的25%,較2016年的8家明顯增加;限期整改企業43家,占55%;檢查期間處于停產狀態的企業16家,占20%。“檢查79家企業,停產整改20家,25%的比例是適合的。”王愛君表示。
飛檢一方面是對企業的檢查,另一方面也是對各省局的監督檢查。2017年國家食藥監總局對27個省(區、市)開展了檢查。“2017年檢查的省份中,廣東省因醫療器械企業數量眾多,抽檢基數大,飛檢數量自然排在第一,有9家。”王愛君介紹,北京、江蘇、浙江、山東、上海飛檢數量分別為8家、8家、6家、5家、5家。青海、寧夏、西藏、新疆等沒有器械生產企業的省份未涉及。
(責任編輯:齊桂榕)
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:)
右鍵點擊另存二維碼!
-
相關閱讀
-
為你推薦
-
第26期“安安有約——食藥科普大講堂” 美麗520:破解化妝品謠言正當時
5月20日,坊間頗具浪漫色彩的一天,廣東省藥品監督管理局主辦的第26期“安安有約——食藥科普大講堂活動”在廣州舉行,化妝品專家蔣麗剛《破解化妝品謠言》的專題講座也如期開講。 2019-05-27 09:55 -
42a0b751-7d56-4b1c-a143-a99f7da2fa3c_260x150c.jpg)
科普大講堂
2019-04-28 15:07
互聯網新聞信息服務許可證10120170033
網絡出版服務許可證(京)字082號
?京公網安備 11010802023089號 京ICP備17013160號-1
《中國醫藥報》社有限公司 中國食品藥品網版權所有









