17個藥品注冊申請將迎現場核查 含9個優先審評產品
中國食品藥品網訊(記者 落楠) 5月6日,國家藥監局食品藥品審核查驗中心發布通告顯示,計劃對17個藥品注冊申請開展藥物臨床試驗數據核查。這17個藥品涉及糖尿病、慢性腎病等治療領域,其中9個被納入優先審評。
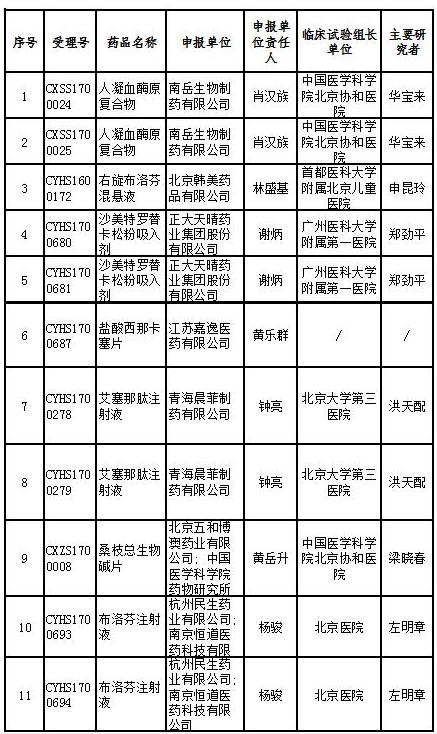
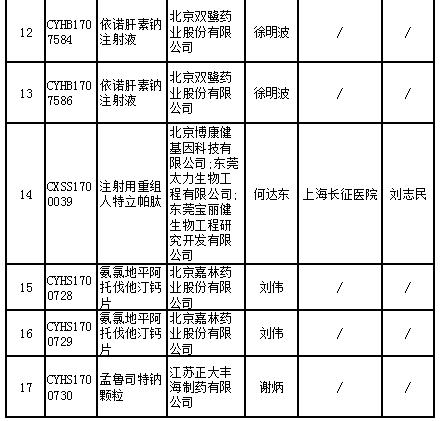
記者查詢國家藥監局藥品審評中心官網發現,被納入優先審評的品種中,人凝血酶原復合物(兩種規格)是罕見病藥物;右旋布洛芬混懸液、艾塞那肽注射液(兩種規格)為列入《關于開展藥物臨床試驗數據自查核查工作的公告》(原國家食品藥品監督管理總局公告2015年第117號)的自查核查項目,申請人主動撤回并改為按與原研藥質量和療效一致的標準完善后重新申報的仿制藥注冊申請;沙美特羅替卡松粉吸入劑(兩種規格)和桑枝總生物堿片被列入國家科技重大專項;鹽酸西那卡塞片屬于專利到期前1年的藥品生產申請。
其他8個產品也或對國內市場產生較大影響。記者在國家藥監局官網檢索相關國產藥品記錄,發現目前布洛芬注射液的批準文號僅有兩個,依諾肝素鈉注射液有15條記錄,注射用重組人特立帕肽、氨氯地平阿托伐他汀鈣片尚無記錄,孟魯司特鈉顆粒僅有1條記錄。
通告顯示,公示期為2019年5月6日至2019年5月17日。公示期結束后,即安排開展現場核查。
17個藥物臨床試驗數據現場核查注冊申請目錄
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:齊桂榕)
















