日本化妝品不良反應管理
- 2021-01-19 12:05
- 作者:葛飛
- 來源:中國食品藥品網
日本具有成熟發達的化妝品消費市場,其化妝品管理體系和中國的化妝品管理體系存在一定的相似性。日本化妝品按照功能功效劃分為醫藥部外品——類似我國的特殊化妝品,實行注冊制管理;化妝品——類似我國的普通化妝品,實行備案制管理。經過長期的發展,日本已經建立了較為完備的化妝品不良反應監測體系和監管制度,很好地應對了過往發生的不良反應事件。本文將從日本化妝品不良反應監管的法規體系、不良反應上報和評估、嚴重不良反應的應對措施及案例三方面進行介紹。
日本化妝品不良反應監管的法規體系
1960年,日本厚生勞動省制定并頒發《藥事法》,經過多次修訂,沿用至今。《藥事法》的管理對象包括醫藥品、醫藥部外品、化妝品和醫療器械等。按照《藥事法》的定義,化妝品是指用于清潔人體、美化,增加魅力、改變容貌或者使皮膚或毛發保持健康狀態,采用涂、擦、噴、灑或類似方法用于身體各部位,對人體的作用是溫和的產品。醫藥部外品是指具有法律規定的或厚生勞動大臣指定的使用目的的產品,對人體作用是溫和的。在我國的屬于特殊化妝品,且在日本屬于醫藥部外品的產品品類包括染發劑、燙發劑、祛斑類產品等。化妝品和醫藥部外品的制造、銷售或進口都必須遵循《藥事法》的規定。
2014年修訂的《藥事法》中涉及不良反應監管的條款為第十一章第六十八條之十(副作用等的報告):“藥品、醫藥部外品、化妝品、醫療器械等的生產銷售企業或外國特例批準獲得者在知曉其可能因其產品副作用及其他原因造成疾病、傷害或死亡情況,或者因產品的使用造成感染癥,或者其他與藥品、醫藥部外品、化妝品或醫療器械的有效性及安全性有關情況后,應當按照厚生勞動省令的相關規定向厚生勞動大臣匯報情況。”
日本的化妝品不良反應定義為“無法否定與化妝品或醫藥部外品有因果關系的病例”。嚴重化妝品不良反應則是指疑似化妝品或醫藥部外品引起的病例中的以下狀況:(1)造成死亡;(2)造成殘疾;(3)可能引起死亡;(4)可能造成殘疾;(5)導致住院治療或住院治療時間延長;(6)治療時間超過30天的病例;(7)引起下一代先天性殘疾的病例等。
與化妝品不良反應監管相關的法律及規范主要有《藥事法實施條例》《醫藥品、醫藥部外品、化妝品及醫療器械制造銷售后的安全管理標準》《藥事法實施條例及醫藥品、醫藥部外品、化妝品、醫療器械的制造銷售后安全管理標準的有關省令的部分修訂省令的施行的有關通知(醫藥部外品及化妝品的副作用等的報告事宜)》《有關醫藥品、醫藥部外品、化妝品及醫療器械的制造銷售后安全管理標準的有關省令的部分修訂省令施行的有關注意事項(有關醫藥部外品及化妝品不良反應等的報告的Q&A)》《有關醫藥品等的副作用等的報告》《有關對應銷售后副作用報告以及臨床試驗副作用報告的E2B(R3)的指南》等。
不良反應的上報和評估
日本化妝品和醫藥部外品的主管部門厚生勞動省實施不良反應報告制度,政府負責化妝品不良反應報告信息的分析及安全對策的制定,厚生勞動省醫藥食品局安全對策科負責安全對策的計劃和立項,獨立行政法人醫藥品醫療器械綜合機構(Pharmaceuticals and Medical Devices Agency,簡稱PMDA)下屬的安全部門接受來自于企業、醫院的不良反應信息,并根據不良反應報告的具體情況向責任單位發布警示及采取必要的措施。化妝品制造銷售企業對不良反應有評價和報告義務,應設立負責統籌管理安全對策的安全管理責任人。
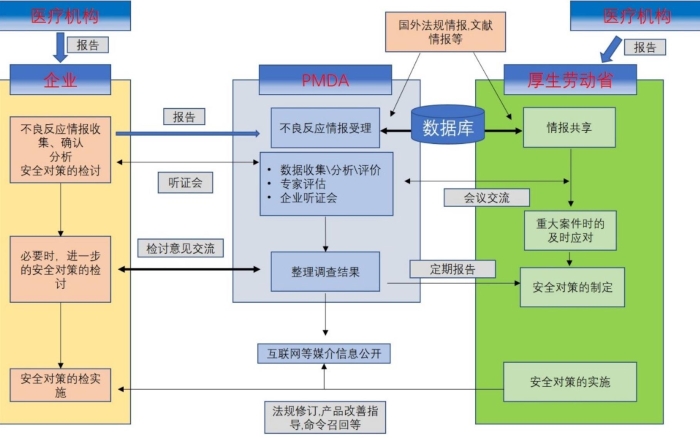
圖1 日本化妝品不良反應報告流程
日本化妝品不良反應信息來源包括以下方面:1)從醫務人員處得來的信息;2)學會報告、文獻報告以及其他研究報告中的信息;3)厚生勞動省、政府其他部門、都道府縣以及獨立行政法人等機構的信息;4)外國政府、外國法人等的信息;5)其他生產銷售企業的信息;6)其他類型的安全管理信息。
企業應對收集到的不良反應信息進行分析判斷是否屬于嚴重不良反應,其中醫生判斷為重癥的病例,均為嚴重病例;醫生判斷為非重癥,但企業判斷為重度的病例,也屬于嚴重不良反應,應進行報告。企業應盡力收集相關詳細信息,以判斷重癥程度,并根據已知信息,按照不同的不良反應類型評估其癥狀程度。根據報告期限之前得到的信息,在懷疑是否屬于應報告病例的情況下,也應進行報告。
不良反應上報時限及范圍
按照《醫藥品、醫藥部外品、化妝品及醫療器械的制造銷售后安全管理標準的有關省令的部分修訂省令》的要求,制造銷售企業必須在15日內上報的事項包括:
①疑似由化妝品等的副作用所引起的發生死亡的案例;
②疑似由化妝品等的副作用所引起的重癥及治療期限超過30天的案例,且無法根據該化妝品等的附件資料或容器包裝上記載的使用注意事項預料的;
③疑似由化妝品等的副作用引起的重癥案例,能夠根據該化妝品等的使用注意事項等預料到,但無法根據該化妝品等的使用注意事項等,預料發生數量、發生頻率、發生條件等發生趨勢,以及該癥狀發生趨勢的變化可能會引起衛生健康危害的發生或擴大的。
必須在30日內上報的事項包括:針對疑似由化妝品等的副作用引起的重癥案例等中的已知情況(參照上述③:能夠根據該化妝品等的使用注意事項等預料到的情況)。報告期限內無法完成全部應報告內容的調查時,應將屆時已完成的調查結果,以及完成全部調查仍需時間的理由一并報告提交。
不良反應上報方式
化妝品不良反應的上報方式可以是郵寄、傳真、電話、在線上報等。標準格式的《醫藥部外品、化妝品不良反應癥狀報告書》要求提交以下內容:(1)患者信息;(2)不良反應信息(不良反應的轉變、重癥程度分級別按代碼記錄);(3)產品及其使用狀況的有關信息:是否同時使用其他醫藥品、醫藥部外品、化妝品等,不良反應發生及處置等的經過,產品成分表(包括非功效原料在內全成分填寫),報告者意見說明等(醫生的意見、與本產品使用的因果關系、作為制造銷售企業所采取的措施);(4)報告人的聯系方式、制造銷售企業名稱及聯系方式、報告負責部門及聯系人等。
2017年4月1日起,厚生勞動省推薦企業使用E2B(R3)來上報醫藥部外品和化妝品上市銷售中出現的嚴重不良反應,并對報告的注意事項作了說明。
不良反應的應對措施及案例
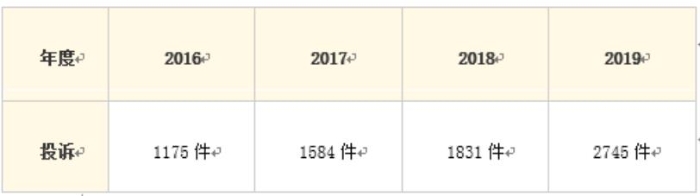
日本內閣的下屬機構消費者廳與獨立行政法人國民生活中心合作,收集消費者來源的化妝品及醫藥部外品的副作用情況。日本的全國消費生活資訊網絡系統(PIO-NET)每年均會出具該系統收集并整理的各類商品的消費者傷害事件的報告,其中包括化妝品項目。2016-2019年,PIO-NET上收到消費者關于化妝品對皮膚傷害的案件數量統計如下:
日本的消費者廳和國民生活中心合作建立了“事故情報數據信息系統”,公眾可以在該系統中查詢各類商品的事故情報。同時消費者廳將對消費者和公眾發布警示通知。警示通知內容包括:化妝品副作用事件的企業產品召回信息(產品照片等)、副作用具體情況、通知消費者的形式、副作用事件案例概況(產生副作用的照片等)、給消費者的建議等。
當企業收到不良反應的情報信息并加以分析之后,應根據危害程度采取相應的應對措施。可采取的措施包括:產品停止銷售、自主召回;修改產品容器、包裝、說明書等標簽中有關使用方法、注意事項的內容;向管理機構提交不良反應報告,如醫藥信息主管或醫療器械信息主管向醫務人員提供相關信息或者向厚生勞動大臣匯報情況;制定其他必要的安全保障措施等。
政府監管機構可以依據《藥事法》對嚴重事件采取應急措施,指導企業停止產品的銷售、召回問題產品等。通過媒體告知社會公眾,引起使用者的注意。根據不良反應的具體原因開展技術評估,修改法規評審要求,避免事態惡化。
杜鵑醇事件
2013年,含有杜鵑醇的化妝品的使用者身上出現白斑癥狀,含有杜鵑醇化妝品的企業實施了自主召回。消費者廳也在網站上公布了召回通知。針對此次事件,日本皮膚科學會成立了“含杜鵑醇化妝品的安全性相關委員會”;厚生勞動省設置了“含杜鵑醇的藥用化妝品引起白斑癥狀的原因調查、防止再次發生的有關研究小組”調查和研究發生的問題,并制定對策。厚生勞動省要求各企業自查產品是否存在 “白斑問題”,厚生勞動省發布《對白斑等病例進行研究報告的通知》,并且最終修訂了《良好藥物警戒質量規范》及藥事法施行規則,擴大了化妝品等信息的收集范圍,實施除研究報告以外的不良反應報告制度。
伴隨著化妝品產業和消費市場的發展,日本化妝品不良反應監測制度也在與時俱進地發展,根據以往不良反應事件的實際情況,監管機構強化了企業的主體責任,且主要聚焦于嚴重不良反應的上報,根據不良反應的嚴重程度,規定了不同的上報期限和應對措施,盡最大努力保證消費者的安全和利益。(作者單位:上海市食品藥品安全研究會)
《中國醫藥報》社版權所有,未經許可不得轉載使用。
(責任編輯:張可欣)
右鍵點擊另存二維碼!
-
相關閱讀
-
為你推薦













